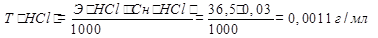Способы титрования в объемном анализе
Прямое титрование. Титрант (рабочий раствор) добавляют в небольшом количестве из бюретки к анализируемому раствору до состояния эквивалентности. Определяют объем титранта по бюретке, результат записывают в журнал. Расчет концентрации производят исходя из закона эквивалентов. Пример: определить эквивалентную концентрацию и титр раствора соляной кислоты, если на титрование 2 мл соляной кислоты пошло 3 мл 0,0205 моль/л раствора NaOH. Решение: реакция, заложенная в определении: HCl + NaOH=NaCl + H2O По закону эквивалентов Cн(HCl)∙ ∙V(HCl) = Cн(NaOH)∙∙ V(NaOH)
Обратное титрование. Метод заключается в последовательном использовании двух титрантов. Первый из них добавляется к определяемому раствору точно отмеренным объемом и в избытке. При этом титрант вступает в реакцию с определяемым веществом, а избыток его (первого рабочего раствора) оттитровывают вторым титрантом до момента эквивалентности. Пример: определить количество в (г) хлорида натрия в растворе, если к его раствору добавили в избытке 10 мл 0,1н раствора AgNO3, избыток нитрата серебра оттитровали в присутствии индикатора железоаммиачных квасцов и на титрование пошло 4 мл 0,1н раствора роданида калия. Решение: Реакции, заложенные в определении: NaCl + AgNO3 = AgCl + NaNO3 AgNO3 (изб.) + KNCS = KNO3 + AgNCS↓ По второй реакции определяют избыток раствора нитрата серебра: Cн(AgNO3)∙ ∙V(AgNO3) = Cн(KNCS)∙∙ V(KNCS)
Объем нитрата серебра, затраченный на реакцию с хлоридом натрия, определяют следующим образом: V (AgNO3)общ. ─ V (AgNO3)изб. =10 − 4 =6 (мл) Количество грамм хлорида натрия определяют по закону эквивалентов:
|