Формулы для перерасчета концентраций.
(плотность (ρ) раствора дана в г/мл)
Приготовление рабочих растворов Растворы титр, которых известен, называются титрованными. Титрованный раствор можно приготовить, если точную навеску растворить в мерной колбе. Например, навеску 0,2750 г Nа2SО4 поместим в колбу на 200 мл и доведем объем дистиллированной водой до метки, то титр приготовленного раствора точно, конечно, известен: Т= 0,2750/200 =0,0013750 г/мл Вещества, из которых готовят растворы с известным титром, называются исходными (стандартными веществами). Исходные вещества должны удовлетворять следующим требованиям: а) они должны быть химически чистыми (примеси не более 0,05-0,1 %); б) состав должен строго соответствовать химической формуле; в) устойчивы при хранении в растворе и в твердом состоянии; г) величина эквивалента должна быть наибольшей. Раствор, приготовленный таким образом, называется стандартными раствором с приготовленным титром. Способ приготовления титрованных растворов зависит от свойств вещества и агрегатного состояния 1. Из веществ кристаллических х.ч. готовят по точной навеске. Например: приготовить 250 мл 0,1н раствора Na2CO3, М(Na2CO3) = 106 г/моль. Эквивалентная масса Э(Na2CO3) = 53 г/моль, Необходимо: а) рассчитать навеску, необходимую для приготовления раствора: m = CH∙ M(1/z Na2CO3)∙V(л) = 0,1∙53∙0,25 = 1,325 (г) б) отвесить навеску на аналитических весах, в) навеску количественно перенести в мерную колбу на 250 мл, растворить в небольшом количестве дистиллированной воды и долить ею до метки, тщательно перемешивая. 2. Приготовление из фиксанала. Готовят раствор, сразу разбивая фиксанал в мерную колбу нужного объема, и вымывают из фиксанала все кристаллы дистиллированной водой и доводят раствор до метки. 3. Из кристаллических веществ, загрязненных, гигроскопичных, летучих и т.д. Необходимо для приготовления; а) рассчитать навеску, б) отвесить ее на технических весах, перенести в любую склянку на 250 мл, растворить в дистиллированной воде и долить до метки, в) установить точную концентрацию приготовленного раствора по исходному веществу (титрованному раствору). Растворы, титр которых находят не по точной навеске, а путем титрования титрованным раствором, называют растворы с установленным титром. Примеры: 1. Приготовить 400мл 0,05 н раствора буры из кристаллической. Решение: Определить массу навески буры, она равна: m= Э(Nа2В4О7∙10Н2О)∙Сн∙V(л)=190,71∙0,05∙0,4=3,81 г. Отвешиваем на аналитических весах навеску, переносим в мерную колбу, тщательно растворяем и доводим до метки 400 мл. 2.Приготовить 100 мл 0,15 н раствора из 3н раствора её. Вопросы к задаче: а) в каких объемах реагируют растворы с одинаковой концентрацией? б) какая зависимость между объемами реагирующих веществ и нормальными концентрациями? Данную задачу можно решить по формуле: Сн1∙ V1= Сн2∙ V2; Сн1 и Сн2 - концентрации растворов моль/л; V1 и V2 – объемы исходного и конечного раствора в мл, V1 = Сн2∙ V2/ Сн1 = 0,15 100 / 3 = 5 мл Значит, для приготовления 100 мл 0,15 н раствора нужно взять 5 мл 3н раствора и довести до метки 100 мл дистиллированной водой. 3.Приготовить 100г 14% раствора, хлорида натрия из 22%- го и 10%-го растворов этой соли. Весовое соотношение исходных растворов находим по правилу смешения (правило креста):
Из большего числа вычитаем меньшее: 22-14= 8 в.ч. 10%-го 14-10 = 4 в.ч. 22%-го Получим 12 г 14% -го раствора Дальше рассуждаем: на 12 г 14%-го раствора нужно 8 г 10%-ного на 100 г Х
на 12 г 14%-го раствора нужно 4 г 22%-ного
Х = 33,3 г Измеряем ареометром плотность исходных растворов. Разделив массы растворов на плотность, получим объемы исходных растворов, необходимых для приготовления нужного раствора. Отмериваем их и переливаем в склянку для использования в работе. Определить титр раствора хлорида натрия, если известно, что на титрование его 10 мл расходовалось 9,2 мл 0,1 н раствора нитрата серебра. Титр можно определить: по закону эквивалентов: (Cн∙V) NaCl = (Cн∙V) AgNO3 Cн (NaCl) = (9,2∙0,1)/10 = 0,092 моль/л, Т = (58,5∙0,092)/1000 = 0,005382 г/мл 58,5 – это эквивалентная масса хлорида натрия.
ФИКСИРОВАНИЕ ТОЧКИ ЭКВИВАЛЕНТНОСТИ Установление состояния эквивалентности является очень важным моментом в проведении анализа. Несоответствие момента прекращения титрования (точки эквивалентности) приводит к возникновению индикаторных ошибок титрования, к неправильным ответам, что чревато последствиями. В принципе, индикаторная ошибка неизбежна при любом определении, но при правильном определении точки конца реакции столь мала, что ею можно пренебречь. Точку эквивалентности можно определить химическими методами (применение индикаторов) и физико-химическими методами (потенциометрическими, кондуктометрическими, фотоколометрическими). В некоторых случаях изменения в системе титрования столь заметны, что не требуется каких то заметных особых приемов для обнаружения конца реакции. Проблема выбора способа фиксирования точки эквивалентности всегда решается применительно к конкретной практике (методике исследования). Чаще всего используют индикаторы. Полученные результаты должны быть достоверны, т.е. должны быть подвергнуты статистической обработке. Методику статобработки см. в данном методическом руководстве.
|







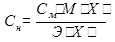

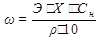



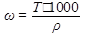




 10% 8 весовых частей
10% 8 весовых частей
 14%
14%
 Х =66,7 г
Х =66,7 г


