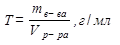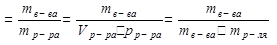Способы выражения концентрации растворов.
Молярная концентрация См – отношение количества вещества в молях (n) к объему раствора в литрах: Если вещество обозначить через X то: Нормальная концентрация или молярная концентрация эквивалента Сн – отношение количества эквивалентов вещества к объему раствора
Молярная и нормальная концентрации связаны между собой: См = Сн∙f или Сн = См /f Титр (Т) – часто используется на практике. Титр раствора –это масса вещества в граммах в 1 мл раствора (г/мл).
Если Т(HNO3) = 0,006354 г/мл, то это значит, что в 1 мл раствора содержится 0,006354 г азотной кислоты. Титр раствора по определяемому веществу – это масса вещества в г, взаимодействующая с 1 мл титранта. Например, Т HCl/NaOH составляет 0,003954 г/мл, это означает, что 1 мл раствора HCl (титранта) реагирует с 0,003954 г NaOH (определяемого вещества). Массовая доля вещества (ω)– – отношение массы растворенного вещества (mв-ва) к массе раствора(mр-ра). Массовая доля – величина безразмерная, ее представляют либо в долях, либо в процентах. Например, для 5%-го раствора хлорида кальция, широко применяемого в медицине, ω%(CaCl2) =5% или в долях ω=0,05. И это означает, что в 100 г раствора содержится 5 г хлорида кальция. ω где ρ – плотность раствора. Моляльная концентрация Cm – отношение количества молей растворенного вещества к 1000 г растворителя, т.е. число молей растворенного в-ва в 1000 г растворителя.
|