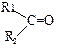Интерпретация спектра
В огромном числе случаев максимальная в спектре величина m/z численно равна молярной массе исследуемого вещества. Этот факт полезен в качественном анализе. Некоторые масс-спектрометрические правила. Определение элементного сос-тава по масс-спектру низкого разреше-ния • 1. "Азотное правило". Большинство встречающихся в органических соединениях элементов имеют либо четную массу основных изотопов и четные валентности (C, O, S, Si, Ge, Pb и др.), либо нечетную массу и нечетные валентности (H, F, Cl, Br, I, As, Sb и др.). Поэтому М+. соединений, составленных из любых комбинаций этих элементов, имеют четную массу. Азот имеет четную массу и нечетную валентность. • 2. "Четно-электронное" правило. Ион-радикалы (нечетное число электронов) могут элиминировать или радикалы, или четно-электронные нейтральные молекулы, тогда как ионы (четное число электронов) могут терять лишь нейтральные четно-электронные части-цы. Следует отметить, что это правило имеет довольно много исключений. • 3. Правило Стивенсона-Одье. При распаде молекул под действием электронного удара положительный заряд локализуется на фрагменте, который обладает наименьшей энергией ионизации. • 4. Затрудненный разрыв связей, принадлежащих к ненасыщенным системам. Разрыв связей, прилежащих к винильной, этинильной или арильной группе, обычно затруднен вследствие очень низкой стабильности обра-зующихся ненасыщенных ионов или радикалов (часто за подобные ионы принимают фрагменты продуктов перегруппировки молекулярных ионов). Одна из важнейших задач - нахождение зависимости между характером масс-спектра и строением исследуемой орг. молекулы. При ионизации орг. молекулы образуется молекулярный ион, в котором далее происходят процессы гетеро- и гомолитического. разрыва связей или разрыва связей с перегруппировкой молекулы и образование осколочных ионов, которые в свою очередь могут подвергаться дальнейшему распаду. Последовательные распады ионов, устанавливаемые из масс-спектра, называются направлениями или путями распада. Направления распада - важная характеристика каждого класса соединений. Совокупность всех направлений распада составляет характерную для каждого органического соединения схему фрагментации. Если масс-спектр прост, схема фрагментации сводится к одному пути распада, например, при распаде молекулярного иона СН3ОН+ последовательно образуются ионы СН2=ОН+ и Н—С=О+. В случае сложных масс-спектров схема фрагментации отвечает многим, часто перекрывающимся направлениям распада, Примером установленных законно-мерностей фрагментации являются следующие схемы разрыва связей: 1. В разветвленных углеводородах наиболее вероятен разрыв связей у места ветвления
3. В ароматических производных наиболее вероятен разрыв β-связей с образованием перегруппировочного тропилиевого иона С7Н7+
4. В масс-спектрах спиртов характерными осколочными ионами являются ионы с массами 31(СН2=ОН+) и М-1 (RCH=OH+), которые соответствуют следующей схеме разрыва связей:
5. Для аминов H2N-CH2-R характерен разрыв α-связи
с образованием иона NH2=CH2 (30). Значительным также является пик H2N=CHR (M-1).
6. Масс-спектр кетонов содержит ионы R1-C=O+ и R2-C=O+. Если алкильная цепь содержит три и более атомов углерода, то происходит отрыв β-связи и далее перегруппировка с участием атома водорода:
7. Алифатические фториды, хлориды и бромиды дают малую интенсивность молекулярного ионного тока, но иодиды имеют значительный пик молекулярного иона. 8. Металлорганические соединения обладают крайне низкой энергией связи металл-углерод, что приводит к резкому уменьшению интенсивности молекулярного иона в масс-спектре.
|

 2. Вероятность разрыва связи С-Н уменьшается с увеличением длины цепи углеводорода
2. Вероятность разрыва связи С-Н уменьшается с увеличением длины цепи углеводорода