Виды химической связи Базовый уровень сложности
1. Связь между атомами двух химических элементов, резко отличающихся по электроотрицательности, является
| 1)
| ковалентной неполярной
| 3)
| металлической
|
| 2)
| ковалентной полярной
| 4)
| ионной
|
2. Соединением с ковалентной полярной связью является
| 1)
| СaO
| 2)
| CO
| 3)
| О2
| 4)
| ВaCl2
|
3. Соединением с ковалентной неполярной связью является
| 1)
| N2O
| 2)
| S8
| 3)
| К2O
| 4)
| SO2
|
4. Соединением с ионной связью является
| 1)
| N2O
| 2)
| Cl2O
| 3)
| Na2O
| 4)
| CО2
|
5. Водородная связь существует между молекулами
| 1)
| этанола
| 2)
| метана
| 3)
| бензола
| 4)
| этена
|
6. По донорно-акцепторному механизму образуется связь в соединении
| 1)
| Вr2
| 2)
| NH4Br
| 3)
| CBr4
| 4)
| BaBr2
|
7. Все соединения отличаются по типу связи между атомами в ряду
| 1)
| S8, SO2, CS2
| 3)
| AlBr3, Br2, N2
|
| 2)
| KCl, Cl2, Cl2O7
| 4)
| PCl5, P4, PCl3
|
8. Полярность связи более всего выражена в молекуле
| 1)
| брома
| 3)
| фосфина
|
| 2)
| сероводорода
| 4)
| хлороводорода
|
9. В оксиде калия и оксиде азота(I) химическая связь между атомами соответственно
| 1)
| ионная и ковалентная неполярная
|
| 2)
| металлическая и ионная
|
| 3)
| ионная и ковалентная полярная
|
| 4)
| ковалентная неполярная и ионная
|
10. Полярность связи Э – Н возрастает в ряду соединений
| 1)
| H2S – НCl – HBr – HI
|
| 2)
| H2O – H2S – NH3 – PH3
|
| 3)
| AsH3 – H2S – HCl – HF
|
| 4)
| HF – H2O – NH3 – CH4
|
11. Число σ-связей в молекуле углекислого газа равно
12. Число π-связей в молекуле бутина-1 равно
Повышенный уровень сложности
13. Соединениями с ковалентной полярной связью являются
| 1)
| оксид серы (VI)
|
| 2)
| метан
|
| 3)
| хлорид цезия
|
| 4)
| кислород
|
| 5)
| хлор
|
| 6)
| хлорметан
|
14. Ионная связь существует в соединениях
| 1)
| оксид углерода (IV)
|
| 2)
| оксид калия
|
| 3)
| фторид кальция
|
| 4)
| йод
|
| 5)
| йодоводород
|
| 6)
| хлорид аммония
|
15. Донором электронов могут быть вещества, формулы которых
| 1)
| H2O
| 4)
| СаС2
|
| 2)
| NH3
| 5)
| CH4
|
| 3)
| B2Н6
| 6)
| HF
|
16. Установите соответствие между названием вещества и видом связи между атомами в нем.
| НАЗВАНИЕ ВЕЩЕСТВА
| ВИД СВЯЗИ
|
| А)
| фторид калия
| 1)
| ковалентная неполярная
|
| Б)
| кальций
| 2)
| ковалентная полярная
|
| В)
| оксид углерода (II)
| 3)
| ионная
|
| Г)
| хлор
| 4)
| металлическая
|
| А
| Б
| В
| Г
|
|
|
|
|
|
| | | | | | |
17. Установите соответствие между формулой вещества и видом связи между атомами в нем.
| ФОРМУЛА ВЕЩЕСТВА
| ВИД СВЯЗИ
|
| А)
| Li
| 1)
| ковалентная неполярная
|
| Б)
| SO3
| 2)
| ковалентная полярная
|
| В)
| KCl
| 3)
| ионная
|
| Г)
| Br2
| 4)
| металлическая
|
| А
| Б
| В
| Г
|
|
|
|
|
|
| | | | | | |
Вариант 1
1. Соединениями с ковалентной полярной и ионной связью являются соответственно
| 1)
| азот и бромид калия
| 3)
| вода и хлорид фосфора (III)
|
| 2)
| бром и хлорметан
| 4)
| сероуглерод и хлорид цезия
|
2. Длина связи Э – Н уменьшается в ряду соединений
| 1)
| SbH3 – AsH3 – PH3 – NH3
|
| 2)
| H2O – H2S –H2Se –H2Te
|
| 3)
| H2S – H2O – HF – HCl
|
| 4)
| HF – H2O –H2S –H2Se
|
3. Число σ-связей в молекуле пропина равно
4. Соединение с ионной связью образуется при взаимодействии между
| 1)
| H2O и CO2
| 4)
| S и F2
|
| 2)
| K и Cl2
| 5)
| H2SO4 и NH3
|
| 3)
| CH3NH2 и HBr
| 6)
| C2H4 и H2O
|
5. Связь, образованная по донорно-акцепторному механизму, существует в молекулах и ионах
| 1)
| CO2
| 4)
| OH-
|
| 2)
| CO
| 5)
| NH3
|
| 3)
| NH4+
| 6)
| H3O+
|
6. Установите соответствие между видом связи в веществе и названием вещества.
| ВИД СВЯЗИ
| НАЗВАНИЕ ВЕЩЕСТВА
|
| А)
| ковалентная неполярная
| 1)
| хлорид бария
|
| Б)
| ковалентная полярная
| 2)
| хлорид фосфора (V)
|
| В)
| ионная
| 3)
| алмаз
|
| Г)
| металлическая
| 4)
| цезий
|
| А
| Б
| В
| Г
|
|
|
|
|
|
| | | | | | |
7. Установите соответствие между формулой вещества и числом σ-связей в молекуле этого вещества.
| ФОРМУЛА ВЕЩЕСТВА
| ЧИСЛО σ-СВЯЗЕЙ
|
| А)
| HCOOH
| 1)
|
|
| Б)
| CH2CHCl
| 2)
|
|
| В)
| CO2
| 3)
|
|
| Г)
| CBr4
| 4)
|
|
|
|
| 5)
|
|
|
|
| 6)
|
|
| А
| Б
| В
| Г
|
|
|
|
|
|
| | | | | | |
Вариант2
1. Соединениями с ковалентной неполярной и ковалентной полярной связью являются соответственно
| 1)
| аммиак и фтор
| 3)
| сероводород и оксид магния
|
| 2)
| йод и хлорид кальция
| 4)
| хлор и сероводород
|
2. Прочность связи Э – Н уменьшается в ряду соединений
| 1)
| SbH3 – AsH3 – PH3 – NH3
|
| 2)
| H2Te – H2S – H2Se – H2O
|
| 3)
| H2S – H2O – HF – HCl
|
| 4)
| HF – HCl – HBr – HI
|
3. Число π-связей в молекуле оксида углерода (IV) равно
4. Водородная связь образуется между молекулами
| 1)
| HF
| 4)
| CH4
|
| 2)
| C6H5COOH
| 5)
| CH3OH
|
| 3)
| H2
| 6)
| CaH2
|
5. По донорно-акцепторному механизму ковалентная химическая связь может образоваться при взаимодействии между
| 1)
| H2O и CaO
| 4)
| Al(OH)3 и KOH
|
| 2)
| HCl и KOH
| 5)
| HF и BF3
|
| 3)
| NH3 и HNO3
| 6)
| CH4 и Cl2
|
6. Установите соответствие между видом связи в веществе и формулой вещества.
| ВИД СВЯЗИ
| ФОРМУЛА ВЕЩЕСТВА
|
| А)
| ковалентная неполярная
| 1)
| PCl3
|
| Б)
| ковалентная полярная
| 2)
| P4
|
| В)
| ионная
| 3)
| Mg
|
| Г)
| металлическая
| 4)
| Na2O
|
| А
| Б
| В
| Г
|
|
|
|
|
|
| | | | | | |
7. Установите соответствие между названием вещества и числом π-связей в молекуле этого вещества.
| НАЗВАНИЕ ВЕЩЕСТВА
| ЧИСЛО π-СВЯЗЕЙ
|
| А)
| уксусная кислота
| 1)
|
|
| Б)
| хлорвинил
| 2)
|
|
| В)
| акриловая кислота
| 3)
|
|
| Г)
| пропин
| 4)
|
|
|
|
| 5)
|
|
|
|
| 6)
|
|
Приложение 1
Химическая связь — это совокупность сил, удерживающих атомы друг около друга.
Деление химической связи на типы условно и связано с природой химических элементов:

Физическая природа разных типов химической связи едина — это ядерно-электронное взаимодействие.
Инертные газы (VIII группа, главная подгруппа) одноатомны:

Внешний электронный слой атомов инертных газов завершенный устойчивый.
Другие изолированные атомы стремятся приобрести конфигурацию внешнего электронного слоя ns2np 6 (или Is2). В результате образуется система связанных атомов и выделяется энергия.
Выделяют четыре типа химической связи.
1. Ионная связь — химическая связь между типичными металлами и типичными неметаллами (большая разница в размерах атомов и электроотрицательностях). Ионная связь между катионами и анионами реализуется за счет электростатического притяжения:
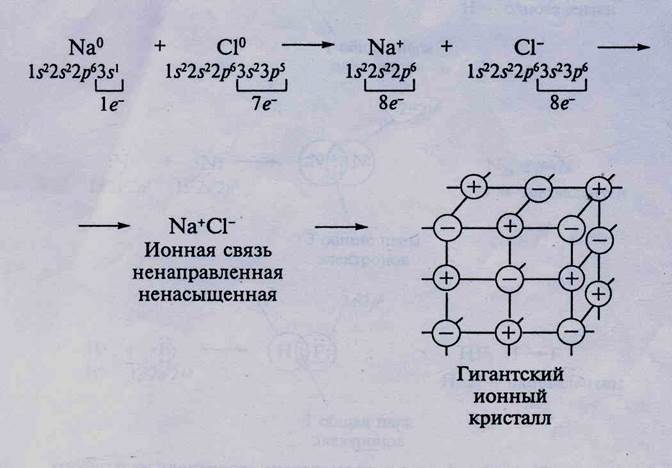
Примеры веществ с ионным типом связи: CaO, LiF, K3N, NaH, ВаС12, CsF (ионность связи 89 %) — твердые, тугоплавкие; их растворы и расплавы электропроводны (NaCI = Na+ + СI-); многие вещества растворимы в Н2O.
2. Ковалентная связь — химическая связь между неметаллами (или металлом и неметаллом с небольшой разницей в размерах атомов и электроотрицательностях). Ковалентная связь образуется с помощью общих пар электронов:
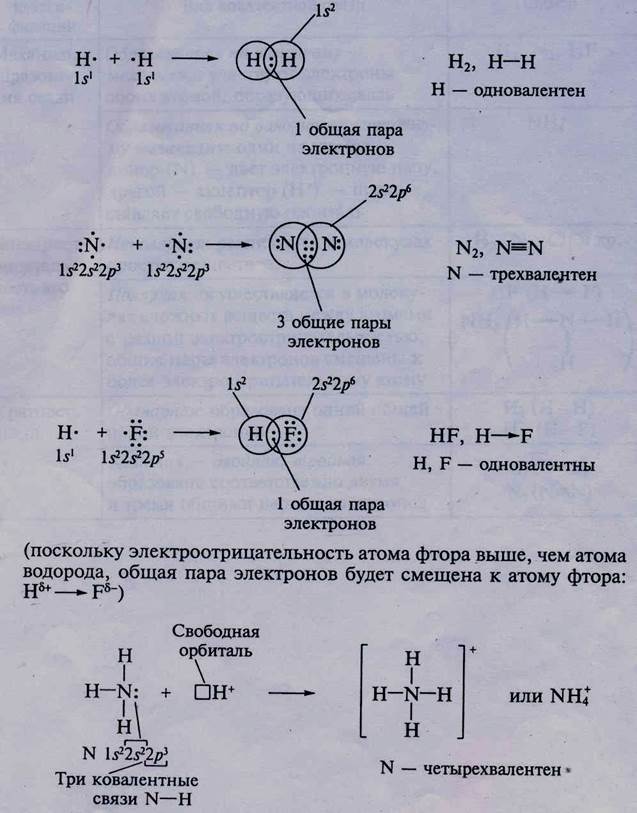
Классификация видов ковалентной связи, свойства и примеру веществ с ковалентными связями представлены в табл. i, 2,3








