Химические свойства хлората калия
1. Диссоциация, pH = 7 2. KClO3 (тв.) + S → KCl + SO2↑ 3. KClO3 (тв.) + P → KCl + P2O5↑ 4. KClO3(тв.) + Al → KCl + Al2O3 (Cr, Fe, Me) 5. KClO3(тв.) + HCl(конц.) → KCl + Cl2↑ + H2O 6. KClO3(тв.) + H2SO4 (конц.) → KHSO4 + ClO2↑ + KClO4 + H2O 7. KClO3 + MnO2 + KOH → KCl + K2MnO4 + H2O (t0C) 8. KClO3 + Cr2O3 + KOH → KCl + K2CrO4 + H2O (t0C) (Fe2O3) 9. KClO3 + KI + H2SO4 → KCl + I2↓ + K2SO4 + H2O (KBr) 10. KClO3 + FeSO4 + H2SO4 → KCl + Fe2(SO4)3 + H2O (CrSO4) 11. KClO3 + FeCl2 + HCl → KCl + FeCl3 + H2O (CrCl2, CuCl) 12. KClO3 + H[SnCl3] + HCl → H2[SnCl6] + KCl + H2O 13. KClO3 + Cu + HCl → H[CuCl2] + KCl + H2O (CuCl2) 14. KClO3 + Cr + KOH → KCl + K2CrO4 + H2O (t0C) 15. KClO3 + NO2 + H2O → KCl + HNO3 16. KClO3 + SO2 + H2O → KCl + H2SO4 17. KClO3 → KCl + O2↑ (MnO2, 1500C) KClO3 → KClO4 + KCl (4000C) 18. KClO3 + H2O Химические свойства хлорида хрома(III), сульфата хрома(III), нитрата хрома(III). (напишите молекулярные, ионные и окислительно – восстановительные реакции, расставьте коэффициенты). 1. Гидролиз по катиону. 2. CrCl3 + NaOH(недост.) → Сr(OH)3↓ + NaCl Сr(OH)3 + NaOH(избыток) → Na3[Cr(OH)6] 3. CrCl3 + NH3.H2O → Сr(OH)3↓ + NH4Cl 4. CrCl3 + AgNO3 → Cr(NO3)3 + AgCl↓ (Pb(NO3)2) Cr2(SO4)3 + BaCl2 → CrCl3 + BaSO4↓ (Pb(NO3)2) 5. CrCl3 + Na3PO4 → CrPO4↓ + NaCl 6. CrCl3 + Na2CO3 + H2O → Cr(OH)3↓ + CO2↑ + NaCl 7. CrCl3 + NaHCO3 → Cr(OH)3↓ + CO2↑ + NaCl 8. CrCl3 + Na2S + H2O → Cr(OH)3↓ + H2S↑ + NaCl 9. CrCl3 + Na3[Cr(OH)6] → + Cr(OH)3↓ + NaCl 10. CrCl3 + CH3COONa → Cr(CH3COO)3 + NaCl Cr(CH3COO)3 + H2O → Cr(OH)3↓ + CH3COOH (t0C) 11. CrCl3 + KSCN → K3[Cr(SCN)6] + KCl 12. CrCl3 + Na2C2O4 → Na3[Cr(C2O4)3] + NaCl 13. CrCl3 + H2O2 + NaOH → Na2CrO4 + NaCl + H2O 14. CrCl3 + Br2 + NaOH → Na2CrO4 + NaBr + NaCl + H2O (Cl2) 15. CrCl3 + NaClO + NaOH → Na2CrO4 + NaCl + H2O (NaBrO) 16. Cr2(SO4)3 + K2S2O6(O2) + H2O → K2Cr2O7 + KHSO4 + H2SO4 NaBiO3 + H2SO4 + KCr(SO4)2 → Bi2(SO4)3 + K2Cr2O7 + Na2SO4 + H2O 17. CrCl3 + H(Zn, HCl) → CrCl2 + HCl 18. Cr(NO3)3 → Cr2O3 + NO2↑ + O2↑ (t0C) Cr2(SO4)3 → Cr2O3 + SO3↑ (t0C) Cr2(SO4)4 → Cr2O3 + SO2↑ + O2↑ (t0C) Химические свойства FeCl3 1. Гидролиз по катиону FeCl3 = Fe3+ + 3Cl- 2. 2FeCl3 + 3F2 = 2FeF3 +3Cl2↑ 3. 4FeCl3 + 3O2 = 2Fe2O3 +6Cl2↑ (> 350 °C) 4. 2FeCl3 + Fe = 3FeCl2 5. 2FeCl3 + Cu = 2FeCl2 + CuCl2 6. 2FeCl3 + H2S = 2FeCl2 + S + 2HCl 7. 2FeCl3 + 2HI = FeCl2 + I2↓+ 2HCl 8. 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl 9. 2FeCl3 + H[SnCl3] + HCl = 2FeCl2 + H2[SnCl6] 10. FeCl3+ HClконц = H[FeCl4] 11. FeCl3 + 2H3PO4 = H3[Fe(РO4)2] + 3HCl 12. 2FeCl3 + H2SO4конц., гор. = Fe2(SO4)3 + 6HCl↑ 13. FeCl3 + 3(NH3. H2O) = 2Fe(OH)3↓ + 3NH4Cl 14. FeCl3 + 3NaOH = 2Fe(OH)3↓ + 3NaCl 15. 2FeCl3 + 3Na2S = 2FeS↓ + S↓ + 6 NaCl 16. 2FeCl3 + KI = 2FeCl2 + I2↓ + 2KCl 17. 2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl 18. FeCl3 + 3NaHCO3 = Fe(OH)3↓ + 3CO2↑ + 3NaCl 19. FeCl3 + 3CH3COONa = (CH3COO)3Fe + 3NaCl (CH3COO)3Fe + 3H2O = Fe(OH)3↓ + 3CH3COOH↑ FeCl3 + 3CH3COONa + 3H2O = Fe(OH)3↓ + 3NaCl + 3CH3COOH↑ 20. FeCl3 + 6KNCS = K3[Fe(NCS)6] + 3KCl 21. FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl 22. FeCl3 + 3AgNO3 = Fe(NO3)3 + 3AgCl↓ 23. 2FeCl3 + 3Pb(NO3)2 = 2Fe(NO3)3 + PbCl2↓ 24. 2FeCl3 + 16KOH + 3Cl2 = 2K2FeO4 + 12KCl + 8H2O 25. 2FeCl3 = 2FeCl2 + Cl2↑ 26. FeCl3 + 2Na2SO3S = Na[Fe(SO3S)2] + 3NaCl Na[Fe(SO3S)2] + FeCl3 = FeS4O6 + FeCl2 + NaCl Химические свойства хлорида, сульфата, нитрата алюминия. (напишите молекулярные, ионные и окислительно – восстановительные реакции, расставьте коэффициенты). 1. Гидролиз по катиону. AlCl3+HOH↔AlOHCl2+HCl Al3++HOH↔AlOH2++H+ Al2(SO4)3+HOH↔ AlOHSO4+H2SO4 Al3++HOH↔AlOH2++H+ 2. AlCl3 + NaOH(недост.) → Al(OH)3↓ + NaCl Al(OH)3 + NaOH(избыток) → Na [Al(OH)4] AlCl3 + NaOH(избыток.) → Na [Al(OH)4 + NaCl 3. AlCl3 + NH3.H2O → Al(OH)3↓ + NH4Cl 4. AlCl3 + AgNO3 → Al(NO3)3 + AgCl↓ (Pb(NO3)2) Al2(SO4)3 + BaCl2 → AlCl3 + BaSO4↓ (Pb(NO3)2) 5. AlCl3 + Na3PO4 → AlPO4↓ + NaCl 6. AlCl3 + Na2CO3 + H2O → Al(OH)3↓ + CO2↑ + NaCl 7. AlCl3 + NaHCO3 → Al(OH)3↓ + CO2↑ + NaCl 8. AlCl3 + Na2S + H2O → Al(OH)3↓ + H2S↑ + NaCl 9. AlCl3 + Na [Al(OH)4] → + Al(OH)3↓ + NaCl 10. AlCl3 + CH3COONa → Al(CH3COO)2 + NaCl Al(CH3COO)2 + H2O → Al(OH)3↓ + CH3COOH (t0C) 11. Al2(NO3)3 → Al2O3 + NO2↑ + O2↑ (t0C) Al2(SO4)3 → Al2O3 + SO3↑ (t0C) Al2(SO4)4 → Al2O3 + SO2↑ + O2↑ (t0C)
Способы получения FeCl2
  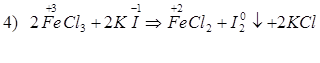
  
  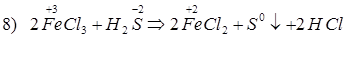
Способы получения FeCl3:
  
  
  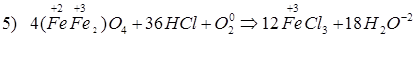
  
  
   
  
  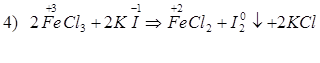
  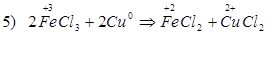
  
  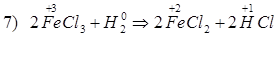
  
  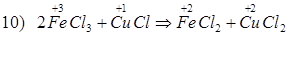
Способы получения FeCl3:
  
  
  
  
  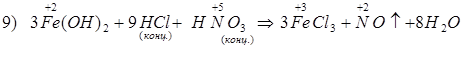
  

  
  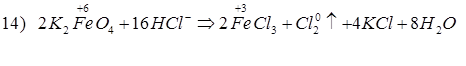
|

 H2↑ + KClO4
H2↑ + KClO4










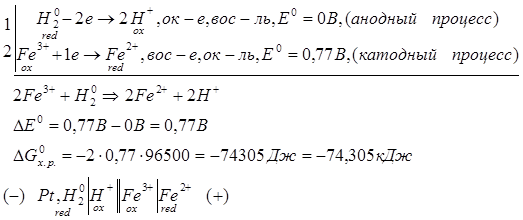



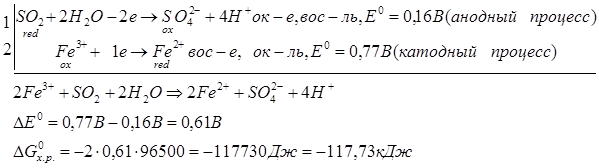















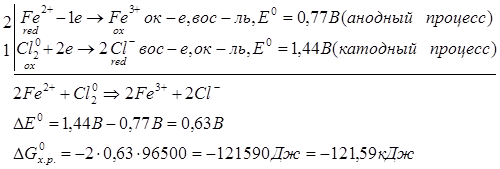





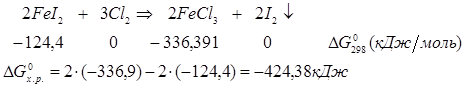



 ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль

 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
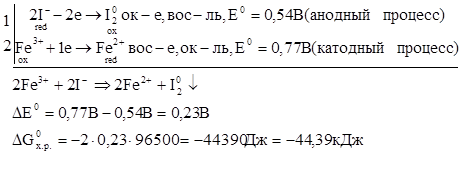
 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль

 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль

 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль



 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль

 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль

 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль




 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
 ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль

 ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль


 ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль

 ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль

 ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
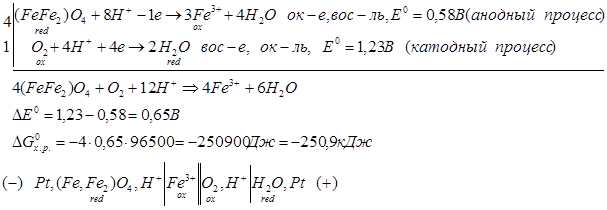
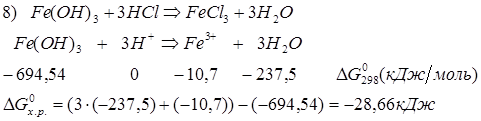
 ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль




 ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль


 вос-е
ок-ль
вос-е
ок-ль



 вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль




