Примеры решения задач. Пример 1.Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г)↔ 2NH3(г), если давление в системе увеличить в 2 раза?
Пример 1. Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г)↔ 2NH3(г), если давление в системе увеличить в 2 раза? Решение Увеличение давления в системе в 2 раза равносильно уменьшению объема системы в 2 раза. При этом концентрации реагирующих веществ возрастут в 2 раза. Согласно закону действующих масс, начальная скорость реакции равна υн = k ∙[N2]∙[H2]3. После увеличения давления в 2 раза концентрации азота и водорода увеличатся в 2 раза, и скорость реакции станет равна υк = k ∙2[N2]∙23[H2]3 = k ∙16[N2]∙[H2]3. Отношение υк./υн показывает, как изменится скорость реакции после изменения давления. Следовательно, υк/υн = k ∙16[N2]∙[H2]3/ k ∙[N2]∙[H2]3=16. Ответ. Cкорость реакции увеличится в 16 раз. Пример 2. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) ↔2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Решение Обозначим концентрации реагирующих веществ: [SO2] = а, [O2] = b, [SO3] = c. Согласно закону действия масс, скорости и прямой и обратной реакций до изменения объема υпр = k ·а2·b; υобр = k1 ·с2 После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3a, [O2] = 3b, [SO3] = 3c. При новых концентрациях скорости υ' прямой и обратной реакций: υ'пр = k ·(3a)2·(3b) = 27·k·a2·b; υ'обр = k1 ·(3с)2 = 9·k1·с2. Отсюда
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3. Ответ. Скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 3. В реакции С(т)+2H2(г) ↔ CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции? Решение Согласно закону действующих масс, начальная скорость реакции равна υн=k ∙[H2]2. После уменьшения концентрации водорода в 3 раза скорость станет равна υк=k ∙(1/3)2[H2]2 =1/9k[H2]2. После изменения концентрации водорода скорость изменится следующим образом: υк/υн =1/9 k [H2]2/ k [H2]2=1/9. Ответ. Скорость реакции уменьшится в 9 раз.
Прмер 4. Во сколько раз возрастет скорость реакции при повышении температуры с 10 до 30 oС (γ; = 3)? Решение При увеличении температуры с 10 до 30 oС скорость реакции в соответствии с правилом Вант-Гоффа возрастает: υ2/υ1 = γ;(t2-t1)/10, где t2 =30 oC, t1 =10 oC, а υ2 и υ1 – скорости реакции при данных температурах. Получаем υ2/υ1 =3(30–10)/10=32=9, т.е. скорость реакции увеличится в 9 раз. Ответ. Скорость реакции увеличится в 9 раз. Пример 5. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 oС, если температурный коэффициент реакции равен 2. Решение Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции при температуре 70 oС больше скорости реакции при температуре 30 oС в 16 раз. Ответ. Скорость реакции увеличится в 16 раз.
Пример 6. Равновесие реакции 2H2(г)+O2(г) ↔ 2H2O(г); ∆H<0 смещается вправо: 1) при уменьшении давления; 2) при увеличении давления? Решение Все вещества в системе – газы. В соответствии с принципом Ле Шателье, повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству молей газов, т.е. в сторону образования Н2О. Следовательно, повышение давления в системе смещает равновесие реакции вправо. Ответ. Повышение давления в системе смещает равновесие реакции вправо.
Пример 7. В какую сторону сместится равновесие реакции 2SO2(г)+O2(г)↔ 2SO3(г); ∆H<0 при повышении температуры?
Решение Поскольку ∆H<0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ. Ответ. Равновесие сместится влево.
Пример 8. Определите константу равновесия реакции NOCl2(г)+NO(г) ↔ 2NOCl(г), если при некоторой температуре равновесные концентрации веществ составляют [NOCl2]=0,05; [NO]=0,55; [NOCl]=0,08 моль/л. Решение Константа равновесия обратимой химической реакции равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции. Поэтому
Ответ. 0,233. Пример 9. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: РСl5(г)↔ РСl3(г)+Сl2(г); ∆Н = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения РСl5? Решение Смещением, или сдвигом химического равновесия, называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (∆Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема газообразных веществ (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Пример 10. Один моль аммиака поместили в сосуд объемом 20 л и нагрели до 600 oC. Давление в сосуде оказалось равным 435 кПа. Рассчитайте степень разложения аммиака. Решение 2NH3(г) ↔ N2(г)+3Н2(г) Количество (моль) газов после реакции: PV/RT = 435∙20/(8,31∙873) = 1,20 моль.
Если разложилось х моль аммиака, то схема разложения: осталось NH3 (1–х); получилось N2 (х/2) + H2 (3х/2)
Из уравнения: 1,20 моль = (1–x) + x/2 + 3x/2 = 1+x получим x = 0,2 моль. Ответ. Степень разложения аммиака 20 %. Пример 11. Константа равновесия реакции N2 + 3H2 ↔ 2NH3 равна 0,1 (при 400 oС). Равновесные концентрации [Н2] = 0,2 моль/л и [NН3] = 0,08 моль/л. Вычислить начальную и равновесную концентрации азота.РешениеЗаписываем выражение для константы равновесия К: K = ([NH3]2/ ([N2]∙[H2]3)Подставляем в выражение для К данные задачи:0,1 = (0,082/ ([N2]∙0,23)Отсюда рассчитываем равновесную концентрацию [N2] = 8 моль / лДалее находим начальную концентрацию азота, учитывая, что из одного моль азота согласно уравнению реакции образуется 2 моль аммиака, т.е. для получения 0,08 моль аммиака требуется 0,04 моль азота. Таким образом, начальная концентрация азота [N2] = 8 + 0,04 =8,04 моль/л. Ответ. Равновесная концентрация азота 8 моль/л, начальная – 8,04 моль/л. Пример 12. Некоторая реакция при 0 oС протекает практически до конца за 4,5 часа (∼16384 с = 214 с). При какой температуре реакция пройдет практически до конца в 1 с (температурный коэффициент скорости равен 2).РешениеПодставляем данные задачи в формулу (3.2): находим t2 /10 = 14. Отсюда: t2 = 140 oС. Ответ. t2 = 140 oС. находим t2 /10 = 14. Отсюда: t2 = 140 oС. Ответ. t2 = 140 oС. Пример 13. Во сколько раз увеличится скорость реакции, протекающей при 300 К, если энергию активации уменьшить на 7 кДж/моль. РешениеВоспользуемся уравнением (3.3). Запишем его для двух скоростей реакций при двух разных энергиях активации, отличающихся на 7 кДж, и поделим одно на другое:
Ответ. В 16,6 раза. Пример 14. При 37 oС реакция заканчивается за 150 с, а при 47 oC − за 75 с. Вычислить энергию активации.РешениеНайдем энергию активации по формуле (3.4).  = 57,1 кДж / моль. = 57,1 кДж / моль. Ответ. 57,1 кДж / моль. Пример 15. Константа равновесия гомогенной системы СО (г) + Н 20 (г) ↔ СО2 (г) + Н2 (г) при 850 °С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх= 3 моль/л, [Н2О] исх = 2 моль/л.
v пр = k1 [СО] [Н2О]; v обр = k2[СО2] [Н2]; Кравн= k1/k2 = [СО2] [Н2]/[СО] [Н2О]. В условии задачи даны исходные концентрации, в то время как в выражение Кравн входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [СО2 ] равн. = х моль/л. Согласно уравнению число молей образовавшегося водорода при этом будет также х моль/л. Столько же молей (х моль/л) СО и Н2 О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут: [С02]равн.= [Н2]равн. = х моль/л; [С0]равн.= (3 –х) моль/л; [Н2О] равн = (2 – х) моль/л. Зная константу равновесия, находим значение х, а затем и исходные концентрации всех веществ: 1= х2/ (3-х) (2 – х); х2= 6 –2х –3х +х2; 5х= 6, х= 1,2 моль/л. Таким образом, искомые равновесные концентрации: [С02]равн. = 1,2 моль/л; [Н2]равн.= 1,2 моль/л; [CO ]равн. = 3 – 1,2 = 1,8 моль/л; [Н2О]равн = 2 –1,2 = 0,8 моль/л.
Ответ. [СО2 ]равн.= 1,2 моль/л, [Н2]равн. = 1,2 моль /л, [CO ]равн. = 1,8 моль/л; [Н2О]равн = 0,8 моль/л. Пример 16. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: РСl5 (г) = РСl3 (г) + Сl2 (г); ΔН0 = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции разложения PCl5?
Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье: а) так как реакция разложения РСl5 эндотермическая (ΔН > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2. Ответ. Для смещения равновесия в сторону прямой реакции необходимо повысить температуру, уменьшить давление и увеличить концентрацию PCl5 или уменьшить концентрации PCl3 или Cl2.
Пример 17. Реакция горения этана выражается термохимическим уравнением С2Н6 (г) + 7 1/2 О2(г) = 2СО2 (г) + 3 Н2О(ж); ΔН = – 1559,87 кДж. Вычислить теплоту образования этана, если известны теплоты образования СО2(г) и H2O(ж).
a) С 2H6 (г) + 3 1/2 О2 (г) = 2СО2 (г) + ЗН 2О (ж); ΔН= – 1559,87 кДж; б) С (граф) + О 2(г) = СО2 (г); Δ Н =. – 393,51 кДж; в) Н2 (г) + 1/2О2 (r) = Н2О (ж); ΔН= –285,84 кДж. На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) − на 3, а затем сумму этих уравнений вычесть из уравнения (а): С2H6 + 7 1/2 О2 – 2С – 2О2 – ЗН2 – 3/2О2= 2CO2+ 3Н2О – 2СО2 –3Н2О; ΔН = –1559,87 + 787,02 + 857,52; С2Н6 = 2С + ЗН2; Δ Н = + 84,67 кДж. Так как теплота образования равна теплоте разложения с обратным знаком, то ΔНобр (С2Н6)(г) = –84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса: ΔН= 2ΔН(CO2) + 3ΔН (H2O)–ΔН0(С2Н6)– 7 1/2ΔН(O2). Учитывая, что теплоты образования простых веществ условно приняты равными нулю, ΔН(С2Н6)= 2ΔН(CO2) + 3ΔН(H2O) – ΔН; ΔН(С2Н6)= 2 (–393,51) + 3 (–285,84) +1559,87 = –84,67; Ответ. ΔН(С2Н6(г)) = – 84,67 кДж. Пример 18. Реакция горения этилового спирта выражается термохимическим уравнением: С2 Н5ОН (ж) + 3О2 (г) = 2СО2 (г) + 3Н2О (ж); ΔН =? Вычислить тепловой эффект реакции, если известно, что мольная теплота парообразования С2Н5ОН (ж) равна +42,36 кДж и известны теплоты образования: С2Н5ОН (г); СО2(г); Н2О (ж).
С2 Н5ОН (ж)= С2Н5ОН (г); ΔНпарооб= +42,36 кДж; + 42,36 = –235,31 –ΔН (С2 Н5ОН (ж)). ΔНС2Н5ОН (ж) = –235,31–42,36 = –277,67 кДж. Вычисляем ΔН реакции, применяя следствие из закона Гесса: ΔН = 2·(–393,51) + 3·(–285,84) + 277,67 = –1366,87 кДж. Ответ. ΔН = –1366,87 кДж. Пример 19. Растворение моля безводной соды Na2СО3 в достаточно большом количестве воды сопровождается выделением 25,10 кДж теплоты, тогда как при растворении кристаллогидрата Na2СО3∙10 Н2О поглощается 66,94 кДж теплоты. Вычислить теплоту гидратации Na2СО3 (теплоту образования кристаллогидрата).
б) Nа2СО3∙10Н2О + аq =Na2СОз aq; ΔН(Na2CO3 aq) = + 66,94кДж. Вычитая уравнение (б) из уравнения (а),получаем ответ: Nа2СО3 + 10H2O = Nа 2СОз·10H2O; ΔН (Nа 2СО3•10H2O) = – 92,04 кДж, т.е. при образовании Na2CO3 ∙10Н 2О выделяется 92,04 кДж теплоты. Ответ. Теплота образования кристаллогидрата Na2CO3∙10Н2О равна –92,04 кДж.
Пример 20. Рассчитайте изменение энергии Гиббса при превращении 1 моль переохлажденной воды при температуре минус 10 °С и давлении 1 атм. в лед. Считайте постоянными в интервале температур от минус 10 до 0° С энтропию кристаллизации DSкрист и энтальпию кристаллизации DН крист. Энтальпия плавления DНпл = 6 кДж/моль [6].
Ответ. ΔG = – 0,2 кДж/моль. Пример 21. Не производя вычислений, определить знак изменения энтропии в следующих реакциях:
NH4NO3 (к) = N2O (г) + 2Н2О (г), (1) 2Н2 (г) + О2 (г) = 2Н2О (г), (2) 2Н2 (г) + О2 (г) = 2Н2О (ж). (3)
Ответ. ∆S1 > 0, ∆S2 < 0 и ∆Sз < 0.
|


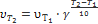 ;
;
 .
.



