Апоптотирующих клеток
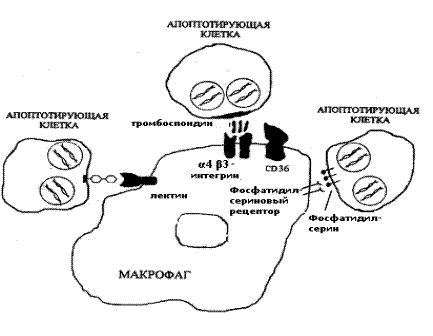
Различные апоптотирующие клетки, в том числе апоптотирующие гранулоциты и лимфоциты, быстро распознаются и поглощаются макрофагами. Выделяют три основных механизма распознавания и удаления клеток, подвергающихся апоптозу. Во-первых, макрофаги с помощью лектинов адгезируют различные клетки, вступающие на путь апоптоза. Это происходит в результате специфической перестройки углеводных компонентов мембран апоптотирующих клеток с потерей терминальных сиаловых кислот мембранными гликопротеидами, что приводит к экспрессии сахаров и снижению общего отрицательного потенциала наружной поверхности мембраны. Во-вторых, распознавание апоптотирующих клеток осуществляется с помощью макрофагального a4b3-интегринового рецептора, а также синтезируемого и секретируемого в микроокружение макрофагами тромбоспондина, выполняющего роль молекулярной «скрепки» между апоптотирующей клеткой и макрофагом. В-третьих, в распознавании апоптотирующих клеток участвует макрофагальный фосфатидилсериновый рецептор. Уже на ранних этапах программированной гибели в апоптотирующей клетке происходит инверсия мембранных фосфолипидов. Нейтральные фосфолипиды с наружного слоя перемещаются на внутренний, а отрицательно заряженные фосфолипиды с внутреннего слоя мембраны перемещаются на наружный слой. В результате экспрессии фосфатидилсерина наружу он распознается специфическим макрофагальным фосфатидилсериновым рецептором. Схематически эти основные механизмы распознавания апоптотических клеток макрофагами, представлены на рис. 12-5.
12.4. РОЛЬ АПОПТОЗА В ПАТОЛОГИИ За последнее десятилетие число опубликованных работ по проблеме апоптоза увеличилось более чем в 10 раз. Особенно возросло число исследований, посвященных роли апоптоза в развитии многообразной патологии, встречающейся в процессе жизни современного человека.
Рис. 12-5. Схема основных механизмов распознавания апоптотических клеток макрофагальными элементами
В зависимости от вида и степени выраженности патологии клетка погибает, как отмечено выше, либо в результате апоптоза, либо некроза. В конечном итоге выбор организмом гибели клеток (апоптоз или некроз) зависит от содержания в этих клетках: · активных форм кислорода (Н2О2, О2–, О–, ОН–), определяемого соотношением активности оксидантной и антиоксидантной (супероксиддесмутаза – СОД, каталаза, селензависимая глутатионпероксидаза, селен, L-карнозин, токоферол, мелатонин и др.) систем; · оксида азота (NO), определяемого, главным образом, активностью индуцибельной, самой мощной, нитрооксидсинтетазы (iNOS), а также конститутивных эндотелиальной (eNOS) и нейрональной (nNOS) синтетаз; · НАД+ и макроэргов (КРФ, АТФ, АДФ) и их соотношения; · провоспалительных (ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-8, a-ФНО, ИФН-g, ГМ-КСФ и др.) и противоспалительных (ИЛ-10, ИЛ-4, ИЛ-22, ИЛ-18 и т.д.) цитокинов и их соотношения; · белков острой фазы (СРБ, a-антитрипсина, кислого a1-гликопротеина, a2-макроглобулина и др.) и их соотношения. Доказано, что значительное снижение в клетках концентрации НАД+ и АТФ, повышение уровня активных форм кислорода (особенно Н2О2, О2–), NO и уменьшение количества ферментных и неферментных антиоксидантов, а также существенное повышение содержания провоспалительных цитокинов и белков острой фазы приводит к развитию и усилению некроза и одновременно к угнетению апоптоза. В последнее время особую роль в развитии как физиологических (в том числе апоптоза), так и патологических (в том числе некроза) процессов отводят важнейшему внутриклеточному медиатору – NO. NO может выполнять роль как молекулы-адаптогена, так и молекулы-разрушителя. Общеизвестно, что в малых (физиологических) количествах NO, определяемых активностью, главным образом, конститутивной нитрооксидсинтетазы, вызывает физиологические (апоптотические) изменения: активирует гуанилатциклазу, повышает содержание и действие цГМФ, снижает агрегацию тромбоцитов и адгезию нейтрофилов к эндотелию, обеспечивает внутриклеточный кальциевый гомеостаз, а также микробицидный и тумороцидный эффект фагоцитов. В больших количествах (на два порядка превышающих нормальные значения и достигающих сотен микромолей на 1 кг массы тканей) NO вызывает развитие дезадаптивных и деструктивных изменений, в частности, повышение проницаемости стенок сосудов, формирование и увеличение отека в тканях, развитие вазодилатации, кардиотоксическое действие, развитие острой сердечной недостаточности, в итоге проводящие к прогрессирующей, вплоть до необратимой, артериальной гипотензии. Известно, что резко сниженный уровень NO сопровождается снижением адаптации организма, а резко повышенный его уровень запускает суицидальную программу (самоуничтожение) клеточно-тканевых структур. И то, и другое необходимо корригировать, используя для этого различные пути, способы и средства лечения. Показано, что в условиях различной (и экзогенного, и эндогенного происхождения) патологии неизбежно возникают нарушения тех или иных звеньев как индукции, так и регуляции процесса апоптоза. Нарушение апоптоза участвует в качестве обязательного компонента формирования многих патологических процессов, при этом характер и выраженность развития патологического процесса определяется направленностью изменения апоптоза (ослаблением или усилением).
12.4.1. Апоптоз как обязательный компонент развития
Ведущая роль апоптоза в реализации многообразных физиологических процессов, в поддержании оптимального клеточного и тканевого гомеостаза, в обеспечении нормального развития клеточно-тканевых структур организма общеизвестна и не вызывает сомнений. Значение же апоптоза в формировании типовых патологических процессов может быть разным: решающим, незначительным и отсутствующим. В обобщающем варианте роль апоптоза в развитии различной патологии представлена на схеме 12-1. Как видно из схемы 12-1, апоптоз играет решающую роль в механизмах стресса, особенно в специфических стрессорных реакциях организма на действие различных интенсивных раздражителей. Общеизвестно, что типичным проявлением системного стресса являются лимфоцитопения и опустошение лимфоидных тканей и органов (тимуса, миндалин, лимфоузлов, пейеровых бляшек кишечника и др.), обусловленные действием избыточно образующихся при стрессорных реакциях глюкокортикоидных гормонов (особенно кортизола). Происходит гибель не только лимфоцитов, но и энтероцитов. Системная апоптотическая гибель клеток отмечается также при септическом шоке. В механизмах данного системного апоптоза важное значение имеют гиперпродукция макрофагами и другими клетками a-ФНО (TNF-a) и активация рецепторов TNFR1. При различных инфекционных процессах апоптотическая гибель клеток зависит, главным образом, от выделяемых микроорганизмами экзотоксинов. Последние в виде суперантигенов выступают в качестве индукторов активационного апоптоза. Сам же инфекционный типовой патологический процесс не является обязательным в развитии апоптоза. Апоптотическое повреждение клеток, возникающее под действием Т-киллеров, отмечается при различных аутоиммунных процессах. Локальная апоптотическая гибель клеток обнаруживается также при постишемической реоксигенации. На начальных этапах развития как лихорадки, так и воспаления апоптоз не является обязательным компонентом в механизмах их развития. Ибо в начале воспалительного процесса гибель клеточно-тканевых структур в очаге воспаления развивается благодаря не апоптозу, а некрозу, сопровождающемуся выходом внутриклеточных структур (в том числе активных гидролаз) наружу, что приводит к последующей некротической

гибели соседних клеточных и внеклеточных образований, вплоть до их гнойного расплавления. По мере протекания воспаления, особенно на поздних этапах его развития, процесс апоптоза начинает занимать все большее и большее место в гибели выполнивших свои защитные функции иммунных клеток (в том числе фагоцитов) с целью более быстрого их обновления. При аллергическом воспалении, особенно в позднюю фазу ГНТ, отмечается замедление элиминации, а значит затруднение гибели эффекторных клеток. Это обусловлено способностью данных клеток к самоподдержанию благодаря выработке аутокринных цитокинов (например, ГМ-КСФ), защищающих эти клетки от апоптоза. Известно, что в развитии опухолей и реализации их отрицательного действия на целостный организм участие апоптоза не является обязательным. В то же время доказано, что при угнетении апоптоза значительно замедляется элиминация как генетически измененных собственных клеток, так и поступивших в организм чужеродных клеток. Таким образом, апоптоз может как быть (что реже), так и не быть (что чаще) обязательным компонентом различных видов патологий (патологических процессов и заболеваний).
12.4.2. Патология, связанная с изменением выраженности апоптоза В настоящее время доказанно, что в развитии различных видов патологии могут иметь значение как ослабление процесса апоптоза, так и его усиление.
|