ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ ДВОЙСТВЕННОСТЬ
Некоторые соединения способны проявлять как окислительные, так и восстановительные свойства. Например, N может проявлять с.о.. от +5 (
С сильными окислителями С сильными восстановителями окисляется, т.е. выступает как восстанавливается, т.е. выступает восстановитель (
с окислителями N –восстановитель с восстановителями N – окислитель
Кроме азотной кислоты, окислительно-восстановительной двойственностью обладают сера, йод, пероксид водорода и ряд других веществ.
СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
1) Составить схему реакций с указанием реагентов и продуктов реакции.
2) Определить с.о.. и отметить элементы, изменяющие в результате реакции с.о. 3) Найти окислитель и восстановитель (S – восстановитель., Cl – окислитель) 4) Составить уравнение электронного баланса. Полуреакция окисления Полуреакция восстановления 5) Найти коэффициенты с учётом выполнения электронного баланса, т. е. так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении. 6) Расставить коэффициенты в уравнении реакции.
|

 ) до -3 (
) до -3 ( ). Поэтому азотистая кислота
). Поэтому азотистая кислота  и её соли, где с.о.. азота равна +3, вступают в реакцию как с сильными окислителями, так и с сильными восстановителями.
и её соли, где с.о.. азота равна +3, вступают в реакцию как с сильными окислителями, так и с сильными восстановителями.


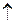 с.о..) как окислитель (
с.о..) как окислитель ( с.о.)
с.о.)
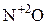

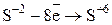 2 1
2 1 8 4
8 4


