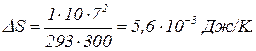Изменения энтропии при теплообмене
Задача 1. В идеальном калориметре находится вода массы М при температуре T01=300°К. В воду бросили брусок массы m=10 г<<M с удельной теплоемкостью 1 Дж/г×К при температуре Т02=293°К. Вода стала отдавать, а брусок получать тепло, так что система стала приближаться к равновесному состоянию. Решение. Так как масса воды гораздо больше массы бруска, можно считать, что при теплообмене температура воды не изменилась. а) Брусок получает количество теплоты, равное б) Полное изменение энтропии всей системы равно сумме малых изменений при передаче малых количеств тепла: Во второй сумме уравнения (5) все слагаемые имеют один и тот же знаменатель, поэтому Так как график ln x в малой области изменения х выглядит приближенно как линейный, легко вычислить Из общего решения задачи, задаваемого уравнением (11), следует, что при большей начальной разнице температур бруска и воды, то есть при большей удаленности начального состояния системы от равновесного состояния, процесс теплопередачи сопровождается большим увеличением энтропии. ВЫВОД: Разность энтропий равновесного и начального состояний является мерой удаленности начального состояния от равновесного. Теплообмен происходит необратимо. Это означает, если нагревание бруска от воды идет самопроизвольно, то отдача тепла от бруска к воде не может происходить самопроизвольно. Процессы, происходящие естественным путем (самопроизвольно), сопровождаются увеличением энтропии. Вопрос 1. Можно ли каким-нибудь способом вернуть описанную в задаче систему в исходное состояние? Что можно будет сказать об энтропии всего мира в результате описанного выше процесса? Если энтропия какого-либо тела уменьшается, то это происходит только за счет того, что энтропия каких-либо других тел увеличивается, причем на величину не меньшую, чем наблюдаемое уменьшение. Используя понятие энтропии, второе начало термодинамики можно сформулировать следующим образом: при всех процессах, протекающих в природе самопроизвольно, энтропия всего мира увеличивается или остается неизменной. Вопрос 2. Можно ли систему из двух тел, находящихся при разных температурах T1 и T2, T1¹T2, перевести в равновесное состояние (T*1=T*2) без увеличения энтропии? Задание. Используя формулировку второго начала термодинамики в терминах энтропии, покажите необходимость существования холодильника у тепловой машины. Замечание. Тепловая машина преобразует неупорядоченный вид энергии (тепловая энергия хаотического движения молекул) в упорядоченный вид (кинетическая энергия маховика или потенциальная энергия поднятого груза, сжатой пружины.) Это преобразование происходит ценой увеличения энтропии холодильника. Увеличение энтропии является платой за производство работы.
|

 . (1)
. (1)  (2)
(2)  . (3)
. (3)  (4)
(4)  (5)
(5)  (6)
(6)  (7)
(7) (8)
(8)  (9)
(9)  (10)
(10) : он равен отклонению от единицы, умноженному на тангенс угла наклона графика ln x к оси ОX в точке х=1. Этот тангенс равен 1. Поэтому
: он равен отклонению от единицы, умноженному на тангенс угла наклона графика ln x к оси ОX в точке х=1. Этот тангенс равен 1. Поэтому  . Данный результат можно было получить сразу без хлопот из (5) или (7), если учесть, что T2 почти не изменяется. Таким образом,
. Данный результат можно было получить сразу без хлопот из (5) или (7), если учесть, что T2 почти не изменяется. Таким образом,  (11)
(11)