Влияние давления на растворимость газов. Закон Генри
Отношение растворимости газа к давлению при постоянной температуре является постоянной величиной[6] (растворимость чаще всего выражается в г/л и обозначается q):
Величина К' может служить мерой растворимости газа в жидкости. Уравнение (VI, 1) является выражением закона Генри, найденного (1803) опытным путем. Нетрудно видеть, что уравнение (VI, 1) есть иная форма уже рассмотренного ранее уравнения Рауля-Генри (V, 4):
Если для раствора газа соблюдается уравнение (V, 4), то такой раствор, в соответствии с ранее сказанным, является предельно разбавленным раствором. Для него справедлив закон Рауля и все закономерности для этих растворов, рассмотренные в главе V. Выразим весовое количество mгаз растворенного газа, находящегося во всем объёме V раствора, через объём, занимаемый газом при тех же температуре и давлении. По уравнению Клапейрона – Менделеева:
откуда следует, что
где Подставив в уравнение (VI, 1) значение
получим:
сокращая величину P и объединяя постоянные величины, получаем:
Отношение Растворимость газа может быть выражена также в объёмах газа, приведенных к 0°С:
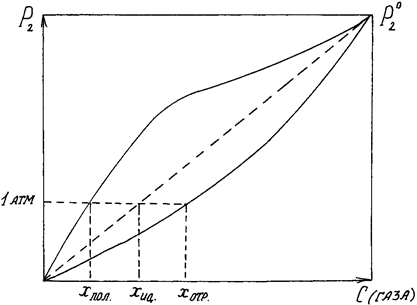
Величина b называется коэффициентом поглощения газа и, так же как a, не зависит от давления газа (в границах применимости закона Генри). По значению коэффициента растворимости можно найти концентрацию растворенного газа, выраженную в любых единицах. Идеальная растворимость газа, т. е. растворимость его в идеальном растворе, может быть вычислена по закону Рауля – Генри (для Р = 1 атм),если считать приближенно газ идеальными положить P 2 = 1 атм: x = где Из уравнения (VI, 4) вытекает, что идеальная растворимость газа не зависит от природы растворителя. Её зависимость от давления выражается графически прямой линией. В растворах, близких к идеальным, а тем более в растворах с положительными отклонениями давление растворенного газа резко возрастает с увеличением его концентрации ( Поэтому растворимость (выраженная в мольных долях) газов, образующих идеальные растворы или растворы с положительными отклонениями, при обычных давлениях мала. Значительно больше растворимость газов, образующих растворы с отрицательными отклонениями. Это положение иллюстрирует рис.14, из которого видно, что кривая P 2 = f (x)для раствора с положительными отклонениями от закона Рауля пересекает изобару Р = 1 атм при меньших концентрациях, чем прямая P 2= x пол. < x ид. < x отр. В табл.4 приведены значения растворимостей некоторых газов в разных растворителях при 20°С и 1 атм.
Рис.14. Парциальное давление газа над его растворами.
Таблица 4. Растворимость некоторых газов при 20°С и 1 атм
Как видно из таблицы, растворимость так называемых постоянных газов (Н2, N2, О2) мала (сотые и десятые доли мольных процентов). Газы с полярными молекулами сравнительно мало растворимы в неполярных и малополярных жидкостях. Большие отрицательные отклонения и, соответственно, очень большие растворимости СO2 и NH3 в водных растворах обусловлены, с одной стороны, химическим взаимодействием с водой, сильно уменьшающим количество свободных молекул СO2 и NH3 в растворе, и, с другой стороны, гидратацией этих молекул, за счёт чего значительно понижается их летучесть. Растворение газов в жидкостях сопровождается, как правило, выделением теплоты. Исключением являются растворы водорода и инертных газов в органических растворителях, которые образуются с поглощением теплоты.
|

 = K' (VI, 1)
= K' (VI, 1)

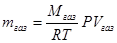 ,
,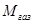 – молекулярная масса газа и Vгаз – его объём.
– молекулярная масса газа и Vгаз – его объём.
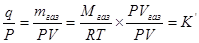 (VI, 1а)
(VI, 1а) (VI, 2)
(VI, 2) ,называемое коэффициентом растворимости газа, не зависит от давления (для идеальных и предельно разбавленных растворов идеальных газов). Величина a показывает, сколько объёмов газа растворяется в одном объёме раствора при данной температуре (объем газа измеряется при тех же значениях Т и P, при которых установилось равновесие газ-раствор).
,называемое коэффициентом растворимости газа, не зависит от давления (для идеальных и предельно разбавленных растворов идеальных газов). Величина a показывает, сколько объёмов газа растворяется в одном объёме раствора при данной температуре (объем газа измеряется при тех же значениях Т и P, при которых установилось равновесие газ-раствор).


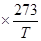 (VI, 3)
(VI, 3)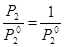 (VI, 4)
(VI, 4) - давление насыщенного пара сжиженного газа[7] при той же температуре, при которой определяется растворимость.
- давление насыщенного пара сжиженного газа[7] при той же температуре, при которой определяется растворимость. x для идеального раствора, и тем более, чем кривая P 2 = f (x) для раствора с отрицательными отклонениями. Следовательно, и растворимости газов в соответствующих растворах
x для идеального раствора, и тем более, чем кривая P 2 = f (x) для раствора с отрицательными отклонениями. Следовательно, и растворимости газов в соответствующих растворах