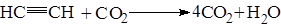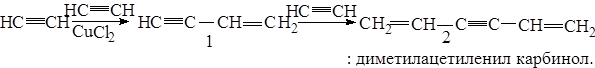Общая характеристика. При рассмотрении химических свойств ацетиленовых углеводо-родов следует учитывать особенности ацетиленовой связи
При рассмотрении химических свойств ацетиленовых углеводо-родов следует учитывать особенности ацетиленовой связи. Оба углеродных атома в ацетилене находятся в sp – гибридном состоянии. Электронная формула для углерода в возбужденном состоянии запишется так:
Химическое поведение алкинов в синтезах обусловлено, с одной стороны, тем, что тройная связь вступает в реакции электрофильного и, реже, нуклеофильного присоединения и, с другой стороны, тем, что водород, соединенный с ацетиленовой группой, обладает кислыми свойствами и может замещаться при действии сильных оснований с образованием ацетиленидов. Кислые свойства ацетиленовых углеводородов невелики по сравнению с минеральными кислотами, но их кислотность в 1018 раз больше, чем кислотность водорода в алканах. Константа диссоциации Ка Н2О 10-16 НСºСН 10-22 СН3 –СН3 10-40 Причиной кислых свойств ацетилена является сильная поляризация связи С-Н благодаря тому, что в sp-гибридной форме углеродный атом (ядро) значительно сильнее удерживает электроны, чем в sp2 и sp3 гибридизации. Доля s орбиталей соответствует 50 %, а в sp3 всего 25%, а радиус s орбитали относится к радиусу р орбитали как 1:1,73. Таким образом, чем большим s и меньшим р- характером обладает sp-гибридизованная орбиталь, тем в большей степени форма этой орбитали приближается к сферической и электроны плотнее удерживаются ядром. Алкины могут вступать в реакции присоединения Аde,Adr – редко, кроме того возможны реакции замещения, полимеризации, изомеризации и окисления.
4.2. Реакции присоединения
Тройная связь по реакционной способности похожа на двойную связь, но не превосходит ее по активности. Присоединения, характерные для кратных связей, в случае тройной связи происходят в две ступени.
4.2.1. Присоединения водорода (реакции гидрирования)
Водород в момент выделения не взаимодействует с тройной связью, так же как и с двойной связью, но газообразный водород в присутствии катализатора восстанавливает алкины сразу до алканов.
Можно осуществить и первую ступень этой реакции, если взять менее активный катализатор Pd (отрав) PbCO3 при гидрировании получаются цис-алкены, а при восстановлении Na, Li в NH3 транс-алкены (реакция была приведена ранее).
4.2.2.Присоединение галогенов
Реакция протекает в две стадии. Реакция с Br2 является качественной реакцией на двойную и тройную связь. Энергично протекает первая стадия (транс, присоединение). Скорость реакции уменьшается от Cl2 к J2;
4.2.3.Присоединение галогеноводородов
Реакция идет в две стадии по правилу Марковникова.
Один из способов промышленного получения хлористого винила. Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
4.2.4. Присоединение воды
Реакция гидратации происходит в присутствии катализатора Hg2+ в кислой среде. Ацетилен присоединяет воду в соответствии с правилом Марковникова.
Подобное взаимное превращение енола в альдегид или кетон происходит по правилу Эльтекова. Из гомологов ацетилена получают кетоны.
Первая реакция была открыта М.Г. Кучеровым и используется в промышленности для получения ацетальдегида, который затем превращают в уксусную кислоту (А.Е. Фаворский, М.Ф. Шостаковский).
4.2.5.Присоединение спиртов
При каталитическом воздействии КОН под давлением ацетилен и его гомологи присоединяются к спиртам с образованием простых алкил-виниловых эфиров.
Реакция осуществляется в промышленности для получения полимеров.
4.2.6. Присоединение карбоновых кислот
В условиях гетерогенного катализа ацетилен присоединяет уксусную кислоту, образую сложный виниловый эфир (винилацетат) – важный исходный продукт для полимеризации в поливинилацетат, гидролизируемый в поливиниловый спирт.
4.2.7. Присоединение трихлористого мышьяка
идет в присутствии катализаторов HgCl2, AlCl3 и др. в две стадии.
b-хлорвинилдихлорарсин (люизит) – ОВ кожно-нарывного действия.
Это один из трех промышленных способов получения акрилонитрила (искусственной шерсти).
4.3. Кислые свойства алкинов
Водородные атомы легко подвергаются протонизации, о чем было сказано раньше. При взаимодействии ацетилена с аммиачным раствором окиси серебра или полухлористой меди выпадает осадок нерастворимых ацетиленидов серебра AgCºCAg (белый цвет) и CuCºCCu ацетилениды меди – вишнево-бурого цвета. Эти ацетилениды взрывчаты.
Эта реакция является качественной на ацетилен (используется для обнаружения люизита). Раствор металлического натрия в жидком аммиаке также замещает подвижные атомы водорода в ацетилене.
4.4. Реакция окисления
Ацетеленовые углеводороды легко окисляются при действии окислителей. Раствор KMnO4 обесцвечивается при прохождении в него ацетилена. Это может так же служить качественной реакцией на СºС связь.При поджигании горят.
4.5. Реакция полимеризации
Исключительно важны реакции полимеризации ацетилена: ацетиленовые углеводороды способны полимеризоваться в нескольких направлениях. а) при нагревании в присутствии активированного угля (Н. Д. Зелинский) или лучше в присутствии Ni(CO)4, [(C6H5)3 P]2 ацетилен образует бензол: (В. Peппe.)
б) под действием комплексных солей меди происходит линейная полимеризация с образованием винилацетилена (I) и дивинилацетилена (2).
в) при действии на ацетилен комплексным соединением никеля образуются циклические соединения с большим числом углеродных атомов, чем в бензоле. (B. Peппe.)
Все эти процессы имеют практическое значение.
4.6. Реакции конденсации.
Реакция Фаворского – конденсация ацетилена с ацетоном в абсолютном эфире, в присутствии сухого порошкообразного KOH:
Ацетилен является ценным исходным веществом для многих промышленных синтезов: C2H5OH, CH3CHO, CH3COOH. синтетических каучуков (изопреновой, хлорпреновой пластмасс), волокон (нейлон, нитрон), инсектицидов, отравляющих веществ, растворителей, красителей и т.д.
ЗАКЛЮЧЕНИЕ
На данной лекции мы рассмотрели состав, строение, изомерию, номенклатуру, физические и химические свойства ацетиленовых углеводородов. При подготовке к занятиям особое внимание уделить номенклатуре алкинов, зависимости свойств алкинов от их электронного строения. Обратить внимание на различие в некоторых свойствах алкинов и алкенов (наличие кислого водорода при тройной связи, отсутствие геометрической изомерии и т.д.).
|














 HCºCH+H-C ºN H2C=C-CºN
HCºCH+H-C ºN H2C=C-CºN