Парциальное давление компонента в паровой смеси
РЕКТИФИКАЦИЯ
Лабораторно-практическая работа № 13 по процессам и аппаратам химической технологии и защиты окружающей среды Чебоксары 2011
Цель: Изучение основ расчета процесса ректификации. Общая последовательность выполнения работы 1. Изучить теоретическую часть и подготовить устные ответы на контрольные вопросы. 2. Выполнить и сдать расчетную часть работы. 3. Изучить устройство экспериментальной установки и порядок выполнения опытов. Провести опыты, заполнить таблицу 6 измерений и показать на t-x-y и у-х диаграммах рабочие линии проведенных процессов. Написать выводы по работе. Защитить экспериментальную часть работы. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Основные понятия, определения Дистилляция – процесс извлечения летучих веществ из жидкости путем их испарения и последующей конденсации полученных паров. Парциальная конденсация – частичная конденсация смеси паров летучих веществ. Ректификация – процесс разделения смеси летучих веществ путем осуществления массообмена между неравновесными потоками пара и жидкости, которые движутся противотоком. Дистиллят – продукт процесса ректификации, обогащенный легколетучими компонентами (ЛЛК). Кубовый остаток – продукт процесса ректификации, обогащенный труднолетучими компонентами (ТЛК). Составные части ректификационной колонны: верхняя - укрепляющая, концентрирующая часть; нижняя - исчерпывающая, отгонная часть. Теоретическая ступень – часть ректификационной колонны, на которой изменение концентрации равно движущей силе массообмена по концентрациям уходящих со ступени потоков пара и жидкости. Тарелка массообменная барботажная – устройство для массообмена при прохождении отдельных пузырьков и струй пара (газа) через слой жидкости. Эффективность тарелки по паровой фазе – отношение фактического изменения концентрации ЛЛК в паровом потоке к теоретически возможному при достижении фазового равновесия. Флегмовое число – отношение потока флегмы, возвращаемого в колонну, к потоку дистиллята, который выводится как продукт разделения. Константа фазового равновесия Азеотропная смесь – смесь, при кипении которой образуется паровой поток такого же состава, что и состав жидкости.
Парциальным называют давление, которое оказывал бы компонент, если бы он один занимал весь объем при температуре смеси. Равновесное парциальное давление компонента над жидкой смесью рассчитывают в соответствии с законами Дальтона и Рауля
где P S и Piо (T) – абсолютное общее давление в системе и давление насыщенных паров компонента, Па, кПа, МПа, мм рт. ст.; yi и xi – мольная доля i-го компонента в паровой и жидкой фазах; gi – коэффициент активности компонента в жидком растворе. Зависимость давления насыщенных паров чистого вещества от температуры описывается уравнением Антуана
Температуру начала кипения жидкого раствора (х 1, х 2, … xi)и температуру начала конденсации паровой смеси (у 1, у 2,.. yi) определяют по тождествам
|

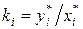 – отношение мольных концентраций компонента в паровой и жидкой фазах в условиях фазового равновесия.
– отношение мольных концентраций компонента в паровой и жидкой фазах в условиях фазового равновесия.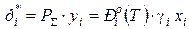 , (1a)
, (1a)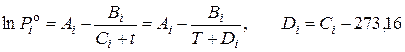 . (1б)
. (1б)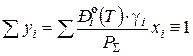 , (1в)
, (1в)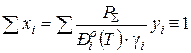 . (1г)
. (1г)


