Химическая связь
Выделяют три типа химической связи: ковалентную, ионную и металлическую. Ковалентная связь – химическая связь, осуществляемая общими электронными парами. В соответствии с методом валентных связей (ВС) ковалентная связь между двумя атомами осуществляется общей для этих атомов парой электронов с противоположными спинами. В момент образования связи атомные орбитали перекрываются, что приводит к увеличению электронной плотности между ядрами взаимодействующих атомов и к взаимному притяжению ядер к области повышенной электронной плотности. В результате этого происходит выделение энергии и потенциальная энергия системы уменьшается. Общая для двух атомов электронная пара может образовываться по двум механизмам: обменному или донорно-акцепторному. При обменном механизме два связываемых атома (А и В) предоставляют для образования связи по одному неспаренному электрону, как бы обмениваясь ими:
А +В→ А В А
Донорно-акцепторный механизм образования связи заключается в том, что один атом А (донор) на образование связи предоставляет пару электронов, а другой атом В (акцептор) – вакантную атомную орбиталь. Различают две разновидности ковалентной связи: неполярную и полярную. Ковалентная неполярная связь – это связь, при которой область повышенной электронной плотности расположена симметрично относительно ядер обоих атомов. Такая связь образуется между атомами с одинаковой электроотрицательностью (ЭО), например, в молекулах Cl2, O2, H2 и др. Ковалентная полярная связь – это связь, при которой область повышенной электронной плотности смещена к ядру атома с большей ЭО. В результате этот атом приобретает эффективный отрицательный заряд, а на другом менее электроотрицательном атоме возникает равный по величине эффективный положительный заряд. Такая система представляет собой электрический диполь. Полярная связь образуется между атомами с разной ЭО, например, в молекулах HCl, HI, H2O, H2S, CO и др. Чем больше разность электроотрицательностей атомов, образующих связь (∆ЭОА – В), тем выше полярность связи. Важнейшие свойства ковалентной связи – насыщаемость и направленность. Насыщаемость – это способность атомов образовывать ограниченное число ковалентных связей. В случае обменного механизма число связей равно числу неспаренных валентных электронов атома. Способность атома к образованию химических связей характеризуется валентностью. Валентность определяется как число химических связей, которыми данный атом соединен с другими атомами. Она зависит от того, в каком состоянии - основном или возбужденном находится атом. Основное состояние – это устойчивое состояние с наименьшей энергией. При возбуждении спаренные валентные электроны разъединяются и переходят с одного подуровня на свободные АО другого, энергетически более высокого подуровня в пределах внешнего энергетического уровня. В результате число неспаренных электронов увеличивается, и атом данного элемента образует максимально возможное для него число химических связей, проявляя при этом высшую валентность и высшую положительную степень окисления, равную номеру группы в Периодической системе (см. примеры решения задач). Ковалентная связь имеет направленность, которая обусловливает пространственную структуру молекулы, т.е. ее геометрическую форму. В зависимости от способа перекрывания АО различают σ (сигма)-, π; (пи)- и δ; (дельта)- связи.
δ – связи образуют только d – АО. Сигма – связь является самой прочной связью и всегда образуется в первую очередь. Между двумя атомами в молекуле возможна лишь одна σ; – связь.
Гибридизация – это выравнивание энергии различных АО у атома А в результате их смешения перед химическим взаимодействием, что приводит к образованию гибридных орбиталей. В гибридизации участвуют только АО одного уровня, например, 2s и 2p. Каждому виду гибридизации АО соответствует определенная геометрическая форма молекулы. Например, sp – гибридизации (две связи) соответствует линейная форма молекулы (BeCl2), sp2 – гибридизации (три связи) – плоская треугольная (BCl3), Ионная связь – связь между ионами, осуществляемая их электростатическим взаимодействием. Ионная связь возникает между атомами металлов и неметаллов, резко отличающимися по своей электроотрицательности. Механизм образования ионной связи заключается в переходе электронов от одного атома к другому (более электроотрицательному), в результате чего атомы превращаются в противоположно заряженные ионы (катион и анион) и происходит их электростатическое взаимодействие. Свойства ионной связи – ненаправленность и ненасыщаемость. Металлическая связь – это связь, образованная в результате перекрывания валентных орбиталей атомов металлов, в результате чего электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла.
|

 σ – связь обладает осевой симметрией относительно межъядерной оси, и область перекрывания АО лежит на межъядерной оси. Ее могут образовывать s – АО, p – АО и d – АО. Именно σ; – связи определяют пространственную конфигурацию молекул:
σ – связь обладает осевой симметрией относительно межъядерной оси, и область перекрывания АО лежит на межъядерной оси. Ее могут образовывать s – АО, p – АО и d – АО. Именно σ; – связи определяют пространственную конфигурацию молекул:
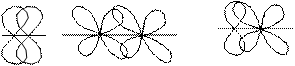 π – связь образуется при перекрывании АО, расположенных параллельно друг другу. Область перекрывания лежит по обе стороны от межъядерной оси. В образовании π; – связи могут участвовать p – и d – АО:
π – связь образуется при перекрывании АО, расположенных параллельно друг другу. Область перекрывания лежит по обе стороны от межъядерной оси. В образовании π; – связи могут участвовать p – и d – АО:
 Для объяснения геометрической структуры молекул (или направленности ковалентной связи) используют представление о гибридизации атомных орбиталей центрального атома в молекуле АВn .
Для объяснения геометрической структуры молекул (или направленности ковалентной связи) используют представление о гибридизации атомных орбиталей центрального атома в молекуле АВn .


