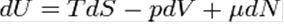Правило фаз Гиббса
Фазой называется совокупность всех гомогенных частей системы, одинаковых во всех точках по составу и по всем химическим и физическим свойствам (не зависящим от количества вещества) и ограниченных от других частей некоторой поверхностью (поверхностью раздела).
Пра́вило фаз (или Правило фаз Гиббса) — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе. Это правило говорит, что в состоянии равновесия системы может одновременно существовать только конечное количество фаз.
Правило фаз записывается следующим образом: j + v = k + n
где j — число фаз (например, агрегатное состояние), v — число степеней свободы, k — компоненты системы (примеры: H2O, CO2), n — число параметров, определяющих равновесное состояние системы.
При переменном давлении (т. е. для жидкостей и газов, т. к. изменение давления на состояние твёрдого тела практически не влияет) правило фаз сводится к выражению: j + v = k + 2.
В случае однокомпонентной системы оно упрощается до: j + v = 3,
что значит, что в однокомпонентной системе при заданном давлении и температуре могут сосуществовать три фазы. На фазовой диаграмме это соответствует тройной точке.
При изменении либо давления, либо температуры могут сосуществовать две фазы и вторая переменная зависима, что соответствует линии. Если фаза одна, то число степеней системы равно двум, и температура и давление могут меняться до тех пор, пока система не окажется на одной из ограничивающих область линий.
Из лекций: Энергией Гиббса (или потенциалом Гиббса, или просто термодинамическим потенциалом в узком смысле) называют термодинамический потенциал следующего вида:
Для квазистатических процессов выполняется следующее соотношение:
Дифференциал энергии Гиббса для системы с постоянным числом частиц:
|