Определение теоретически необходимого количества воздуха
Горение – это реакция соединения горючих элементов топлива (H, C, S) с окислителем. Горение называют химически полным, если в результате процесса горения образуются продукты полного окисления.
При отсутствии избыточного кислорода состав продуктов сгорания при полном горении выражается уравнением:
Если в процессе горения образуются газообразные продукты неполного окисления (CO, H Теоретически необходимым количеством воздуха (V0) называется объем воздуха при нормальных условиях, который требуется для полного сгорания единицы топлива Для определения данной величины V0 запишем стехиометрические химические реакции горения. Для твердого и жидкого топлива, состав которых выражается в процентах веса, эти реакции (стехиометрические соотношения) имеют вид:
12кг+32кг=44кг 4кг+32кг=36кг 32кг+32кг=64кг или 1кг+ Согласно закону сохранения масс (где 12, 32, 44 и т.д. – атомарные и молекулярные веса реагирующих веществ и продуктов реакций. На основании вышеприведенных реакций и учитывая, что воздух содержит 21% кислорода по объёму, получим:
Для газообразного топлива состав выражается в процентах объема. Запишем стехиометрические соотношения процесса окисления горючих компонентов газообразного топлива, учитывая, что 1 кмоль любого газа при нормальных условиях занимает один и тот же объем (22,41 нм3/кмоль). Закона сохранения объёма не существует.
2H 2м 1м3 0.5м3 1м3 1м3 2м3 1м3
2H 2м3 3м3 2м3 2м3 1м3 1.5м3 1м3 1м3 Таким образом, теоретически необходимый объем воздуха для сжигания газ. топлива
где H
|



 и др.), то горение называется химически неполным.
и др.), то горение называется химически неполным.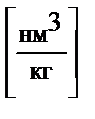 или
или  .
.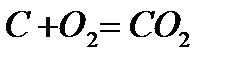
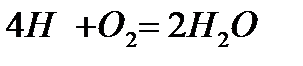
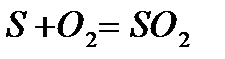
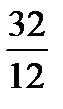 кг=
кг= 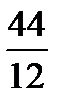 кг 1кг+8кг=9кг 1кг+1кг=2кг
кг 1кг+8кг=9кг 1кг+1кг=2кг , где
, где 
 - вес О2 для окисления 1кг топлива
- вес О2 для окисления 1кг топлива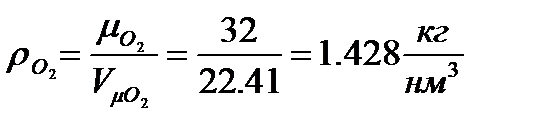 - плотность кислорода при нормальных условиях (
- плотность кислорода при нормальных условиях (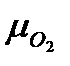 - молекулярный вес О2,
- молекулярный вес О2, 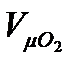 - объём 1 кмоля идеального газа при н.у.)
- объём 1 кмоля идеального газа при н.у.)
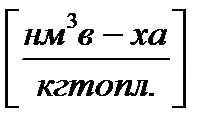 .
.

 +O
+O  +2O
+2O  O
O 1м3 2м3 2м3 1м3 2м3 1м3 2м3 1м3 2м3
1м3 2м3 2м3 1м3 2м3 1м3 2м3 1м3 2м3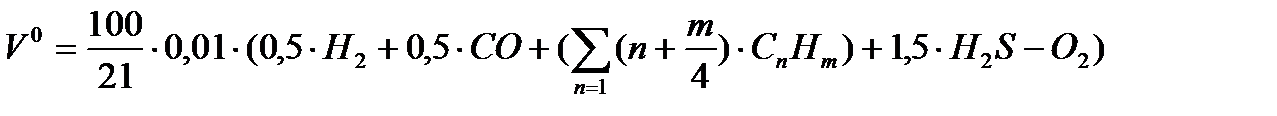
 ,
,


