Розв’язування. Газова стала гелію, кДж/(кг×К)
Газова стала гелію, кДж/(кг×К)
Масові ізохорна та ізобарна теплоємності, кДж/(кг×К)
Питома теплота, що відведена від газу, кДж/кг
Початкова температура газу, К
Кінцева температура гелію, К
Теплоємність політропного процесу, кДж/(кг×К)
Із рівняння теплоємності
визначимо показник політропи Кінцевий тиск газу, МПа
Маса газу, кг
Зміна внутрішньої енергії та ентальпії, кДж
Робота зміни об’єму і тиску, кДж
Зміна ентропії, кДж/К
Зміна ексергії, кДж
Задача 2.1.9. До 1кг азоту з початковими параметрами Р1=0,4 МПа і t1=227оС підводиться 120кДж теплоти. При цьому його внутрішня енергія зменшується на 44,6кДж. Визначити роботу зміни об’єму і зміни тиску, зміну ентальпії, ентропії та ексергії, вважаючи теплоємності незалежними від температури. Температуру навколишнього середовища прийняти рівною 288К Розв’язування Газова стала азоту, кДж/(кг×К)
Ізохорна та ізобарна масові теплоємності, кДж/(кг×К)
Зміна температур в процесі, оС
Кінцева температура газу, К
Теплоємність процесу, кДж/(кг×К)
Із рівняння для теплоємності політропного процесу
визначимо показник політропи Кінцевий тиск газу, бар
Зміна ентальпії, кДж/кг
Робота розширення (зміни об’єму), кДж/кг
Робота зміни тиску, кДж/кг
Отже, на виконання робіт Зміна ентропії процесу, кДж/(кг×К)
Зміна ексергії, кДж/кг
Задача 2.1.10. Два кілограми двоокису вуглецю з тиском Р1=740 мм.рт.ст. і об’ємом 1,15 м3 політропно стискаються, внаслідок чого густина збільшується в п’ять разів, а температура втричі. Визначити теплоту, роботу зміни об’єму, зміну внутрішньої енергії, ентальпії, ентропії та ексергії. В розрахунках прийняти, що теплоємності сталі, k=1,3, а температура навколишнього середовища дорівнює початковій температурі газу.
|

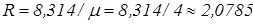 .
.


 .
. .
. або
або 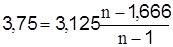
 .
. .
. .
.

 .
. .
.

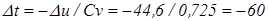



 .
.
 .
.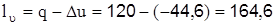 .
. .
.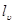 і
і  витрачається зміна внутрішньої енергії та ентальпії, відповідно.
витрачається зміна внутрішньої енергії та ентальпії, відповідно. .
. .
.


