Результаты и обсуждение.
Результаты микробиологического мониторинга госпитальных инфекций представлены на рис.1 и 2.
Рис. 1. Видовой состав возбудителей госпитальных инфекций Приведенный рисунок демонстрирует преобладание в структуре нозокомиальных инфекций ОИТР P.aeruginosa (21,3%). На втором месте по частоте была K.рneumoniae (10,4%), на третьем – S. aureus (6,3%), затем соответственно E.coli (5,5%) и Enterococcus spp. (2,2%). При этом подавляющее большинство данных штаммов было выделено из бронхиального аспирата, мокроты и промывных вод бронхов (рисунок 2).
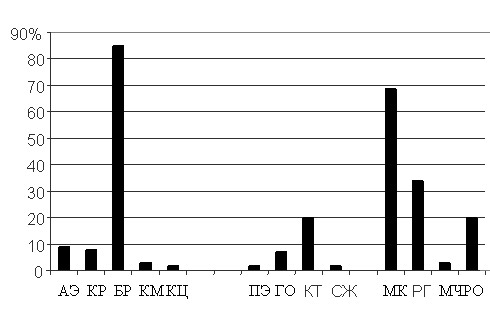
Рис 2. Частота выделение штаммов P. aeruginosa (%) в биологическом материале АЭ – абдоминальный экссудат, КР – кровь, БР – бронхиальный аспират, КМ – катетер мочевой, КЦ – катетер центральный, ПЭ- плевральный экссудат, ГО – гнойное отделяемое, КТ – толстый кишечник, СЖ – спинномозговая жидкость, МК – мокрота, РГ – ротоглотка, МЧ – моча, РО – раневое отделяемое Как видно из рисунка 2, в 85% образцов бронхиального аспирата и в 68% исследуемых образцов мокроты высевалась синегнойная палочка, что собственно и объясняло лидирующее положение респираторных заболеваний в структуре госпитальных инфекций. Далее был проведен анализ чувствительности ведущей госпитальной флоры (синегнойной палочки) к применяемым в отделениях в этот период антибиотикам. Таблица 1. Антибиотикочувствительность и резистентность (%) P. aeruginosa в ОИТР
Как видно из таблицы, P. aeruginosa обладает сверхвысокой резистентностью (91-100%) к природным и полусинтетическим пенициллинам, и даже так называемые «антисинегнойные» (карбенициллин, азлоциллин) и ингибиторзащищенные пенициллины (амоксициллин/клавуланат и ампициллин/сульбактам), к сожалению, не явились исключением. На уровень природной активности антибиотиков этой группы в отношении синегнойной палочки оказывает способность последней к синтезу индуцибельных хромосомных бета-лактамаз класса С (АмрС), активность которых не подавляется сульбактамом, клавуланатом и тазобактамом. Основой феномена являются мутации в генах, регулирующих продукцию указанных ферментов [8, 21]. Высокая резистентность госпитальных штаммов синегнойной палочки отмечена и к цефалоспоринам I-III поколений, обусловленная гиперпродукцией бета-лактамаз, как хромосомных АмрС, так и плазмидных. В свою очередь плазмидные бета-лактамазы типа РSE-1 и РSE-2 устойчивы к бета-лактамазам, но чувствительны к карбапенемам, цефтазидиму, цефепиму и астреонаму, что и определяет несколько меньшую к ним резистентность P.aeruginosa [8, 6]. Наибольшую природную активность в отношении изучаемых госпитальных штаммов сохранили аминогликозиды II (кроме гентамицина) и III поколений, «старые» аминогликозиды (канамицин) значительно уступают им. В основе устойчивости к аминогликозидам лежит три механизма – модификация участка связывания рибосом с антибиотиками, снижение транспорта антибиотика внутрь бактериальной клетки и ферментативная инактивация их плазмидными лактамазами [24]. Из группы фторхинолонов наибольшей природной антипсевдомонадной активностью обладает ципрофлоксацин, однако клиническое значение этой активности подвергается сомнению в связи с тем, что появляются данные о недостаточной способности эрадикации патогена при тяжелых инфекциях, о чем свидетельствуют и полученные нами данные. Формирование приобретенной антибиотикорезистентности связано с активацией систем активного выведения (МехА-МехВ-ОрrМ), а также с возникновением мутаций в области хинолонового кармана» - участка молекулы, воздействие хинолона на который при этом теряется [26, 11]. Стабильно высокая резистентность синегнойной инфекции отмечена к тетрациклинам, нитрофуранам, хлорамфениколу и метронидазолу, т.е. препараты лишены антипсевдомонадной активности. Полученные результаты свидетельствуют о крайне низкой резистентности P. aeruginosa к полимиксину, что связано с нарушением им целостности внешней мембраны микроорганизма. Однако этот антибиотик в настоящее время практически не доступен в широкой клинической практике. Наибольшую природную активность в отношении синегнойной флоры проявляют карбапенемы (тиенам и меронем), что связано со сравнительно небольшой их молекулярной массой, позволяющей им диффундировать через внешнюю мембрану микроба. Этот транспорт облегчает и наличие в молекуле двух противоположных электрических зарядов. Однако природную активность карбапенемов ограничивает наличие у псевдомонад нескольких механизмов устойчивости: выработка бета-лактамаз класса ОХА-31 и бета-лактамаз класса В (металлолактамазы), утрата в результате мутации одного из пориновых белков или снижение его экспрессии и активное выведение липофильных антибиотиков из цитоплазмы – эффлюксные насосы (efflux pump) [8, 13]. Анализ результатов чувствительности госпитальных штаммов P. aeruginosa к карбапенемам тиенаму и меронему выявил существенные различия. Так, к тиенаму чувствительными оказались 69,9%, резистентными -19,1%, промежуточную резистентность показали 11,0% штаммов, в то время как к меронему чувствительными были всего 41,5%, резистентными – 47,7% и промежуточная резистентность выявлена у 10,8% штаммов, т.е. антипсевдомонадная активность тиенама значительно превышает таковую у меронема (количество чувствительных к тиенаму штаммов в 1,7 раза больше, чем к меронему, а количество резистентных в 2,5 раза меньше). Полученные нами столь неожиданные результаты лишь еще раз подтверждают постулат о том, что предсказать чувствительность синегнойной флоры к антипсевдомонадным антибиотикам очень сложно или практически не возможно. Для выяснения причины столь резкого различия в эффективности данных препаратов мы обратились к исследованиям других авторов и нашли следующие возможные объяснения этому факту. Отмечающиеся сопряженные высокие уровни резистентности возбудителя к антибиотикам группы цефалоспоринов I-IV поколений, пенициллинам, фторхинолонам, хлорамфениколу и меропенему при сохраненной чувствительности к имипенему/циластатину свидетельствуют о распространении полирезистентного штамма Pseudomonas aeruginosa и позволяют предположить лидирующую роль гиперактивации системы активного эффлюкса, являющейся молекулярной основой поливалентной устойчивости возбудителя к указанным антибиотикам [23]. Данная теория также объясняет сохранение чувствительности к имипенему/циластатину, поскольку активация эффлюксных насосов (МехАВ-ОрrМ) у синегнойной палочки снижает активность меропенема [10]. Наиболее распространенным механизмом активного эффлюкса является формирование так называемых nalB мутантов, проявляющих активизацию системы MexA-MexB-OprM путем мутации в mexR локусе (замена аминокислоты аргинин на глицин в позиции 70) [23,17,19]. Указанный канал существует в виде неспецифичной активной помпы, расположенной в цитоплазматической мембране, где MexB является собственно насосом, OprM – формирующим канал белком, а MexA – необходимой сшивкой между двумя первыми. NalB мутантный штамм проявляет резистентность к фторхинолонам,?-лактамам, меропенему и хлорамфениколу, сохраняя чувствительность к имипенему. Он может быть получен путем направленной мутации in vitro или селектирован in vivo, в клинических условиях, при использовании антибиотиков пенициллинового, цефалоспоринового и фторхинолонового ряда [9,28,18]. Кроме активного эффлюкса, активация системы MexA-MexB-OprM способна вызывать вторичное угнетение экспрессии OprD поринового канала, опосредуя тем самым возможность снижения проницаемости внешней мембраны для тиенама [2,17,20. 18.29,19]. Частота развития устойчивости к имипенему может быть низкой, поскольку механизмом ее формирования является утрата или снижение экспрессии поринового канала OprD, [18.22] в то время как меропенем индуцирует развитие резистентности по меньшей мере, по двум взаимосвязанным механизмам: гиперактивации системы активного эффлюкса и снижению проницаемости внешней мембраны [17.]. Кроме того, наличие перекрестной устойчивости у меропенема с другими?-лактамами, фторхинолонами и хлорамфениколом создает предпосылку для селекции меропенем-резистентного штамма при использовании указанных антибиотиков [10,29,19,30]. Это объясняет высокий уровень устойчивости к этому карбапенему в стационарах использующих цефалоспорины и фторхинолоны, но не применяющих меропенем. Частая встречаемость резистентности к меропенему может быть также обусловлена большим количеством, по сравнению с имипенемом/циластатином, так называемых «окон селекции» при использовании препарата в дозах, рекомендуемых производителем (0,5-1 г. каждые 8 часов) [12]. С учетом полученных нами данных о распространенности и резистентности к антибиотикам Pseudomonas aeruginosa можно сделать некоторые рекомендации по лечению псевдомонадной инфекции в ОИТР г. Минска. 1. При развитии госпитальных инфекций в ОИТР обязателен микробиологический контроль и назначение антибиотика, уровень резистентности к которому наименьший. При этом обязателен учет локализации и тяжести процесса, особенностей клинической картины, наличия сопутствующей патологии и факторов риска. Полученные результаты по антибиотикочувствительности позволяют провести коррекцию начатой ранее антибиотикотерапии и должны быть использованы при планировании и выборе антибиотика для конкретного больного, а также разработке программ эмпирической антибактериальной терапии в каждом конкретном стационаре 2. Эмпирическую терапию следует начинать неотложно при документированной инфекции. В условиях ОИТР целесообразно использование дескалационного режима антибиотикотерапии препаратами с максимально широким охватом вероятных возбудителей с учетом вероятности мультирезистентных возбудителей. При подозрении или при доказанной псевдомонадной флоре препаратом выбора является тиенам (антипсевдомонадная активность 69,9%), при инфекции, вызванной панрезистентными штаммами P. aeruginosa, наиболее обоснован комбинированный режим терапии с использованием антибиотиком в максимальных дозах, к которым отмечается невысокий уровень резистентности -тобрамицин (52,9% чувствительных штаммов) или амикацин (44,6%), меронем (41,5%), цефтазидим (34,7%). К сожалению, ни один из фторхинолонов не показал достаточной активности и не может быть рекомендован для лечения тяжелой псевдомонадной инфекции в ОИТР. Из-за ограниченного количества наблюдений азитромицин (66,7%) в настоящее время не может быть рекомендован для широкого клинического применения в ОИТР и требует дальнейшего изучения. Необходимо решение вопроса о поставках в РБ полимиксина. Литература
|