Теоретичні відомості. Милом є солі вищих карбонових кислот
Милом є солі вищих карбонових кислот. Як і жири, мило можна класифікувати за агрегатним станом у звичайних умовах. Так, розрізняють тверде мило (натрієві солі вищих карбонових кислот) і рідке мило (калієві солі вищих карбонових кислот). Відповідно, формула мила: С Для добування мила з жиру в промисловості замість лугу використовують соду Na₂CO₃. Мило, добуте безпосередньо внаслідок цієї реакції, називається ядровим милом і відоме як господарське. Туалетне мило відрізняється від господарського наявністю добавок: барвників, запашних речовин, антисептиків тощо. Мийна дія мила – складний фізико-хімічний процес. Мило є посередником між полярними молекулами води і неполярними часточками бруду, нерозчиненого у воді. Якщо позначити вуглеводний радикал буквою R, то склад мила виражається формулою R – COONa. За хімічною природою мило – це сіль, йонна сполука. Крім полярної частини – COO⁻ Na⁺, у його складі є неполярний радикал –R, до складу якого можуть входити 12-17 атомів Карбону. Під час миття молекули мила так орієнтуються на забрудненій поверхні, що полярні групи зведені до полярних молекул води, а неполярні вуглеводневі радикали – до неполярних часточок бруду. Останні ніби потрапляють в оточення молекул мила і легко змиваються з поверхні водою. Синтетичні мийні засоби, за всієї різноманітності їх хімічного складу, мають подібну до мила будову молекул, в яких є розчинена у воді полярна частина і нерозчинений неполярний вуглеводневий радикал. Але вони, на відміну від мила, є солями іншої хімічної природи й у твердій воді не утворюють нерозчинних сполук. У цьому полягає перевага синтетичних мийних засобів над звичайним милом. Мило і синтетичні мийні засоби належать до так званих поверхнево-активних речовин (ПАР). Їхнє широке застосування часто пов’язують із забруднення навколишнього середовища, зокрема водойм. Річ у тім, що до мийних засобів додають фосфати, які у водоймах перетворюються на речовини, що живлять мікроорганізми, чиє бурхливе розмноження може спричинити заболочення водойми. Через це сучасні ПАР повинні хімічно й біологічно розкладатися після використання на нешкідливі речовини, що не забруднюють стоки. Реактиви та обладнання:пробірки,господарське мило, пральний порошок, дистильована вода, тверда вода, соняшникова олія, бромна вода, перманганат калію. Дослід 1. Порівняння властивостей мила і синтетичного мийного засобу. Приготуйте в колбі або хімічному стакані по 20-25 мл розчинів (1%-х) господарського мила і будь-якого прального порошку в дистильованій воді. У дві пробірки налийте по 2-3 мл твердої води. Добавте в одну пробірку розчин мила, в іншу – розчин прального порошку, струсіть вміст пробірок. Дослід 2. Відношення рідких жирів до бромної води і водного розчину перманганату калію. Дослід проводять у двох пробірках, в які попередньо вносять по 2-3 краплі соняшникової олії(або іншого рідкого жиру). Потім у одну пробірку добавляють 3-4 краплі 1%-го розчину перманганату калію. Реакційні суміші в пробірках енергійно перемішують. Спостерігають, як знебарвлюються бромна вода і розчин перманганату. Отже, рідкий жир(олія) – це складний ефір гліцерину і вищих ненасичених кислот, тому він має властивості ненасичених сполук.
Запитання для захисту лабораторної роботи: 1. Де утворюється стійкіша піна? 2.Якого засобу добавляти більше для утворення стійкої піни?
|

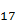 Н₃₅COONa – натрій стеарат та C₁₇H₃₅COOK – калій стеарат.
Н₃₅COONa – натрій стеарат та C₁₇H₃₅COOK – калій стеарат.


