Тема: Комплексные соединения.
Компараторами електричних величин (надалі - компараторами) називають вимірювальні прилади, призначені для порівняння однорідних електричних величин: напруг, струмів, опорів та потужностей. Зокрема, компаратори широко використовують для порівняння невідомої величини змінного струму X з величиною постійного струму Х0, яка еквівалентна до X за ефектом дії і може бути виміряна з високою точністю. Слід мати на увазі, що термін "компаратор" може бути застосований і до інших вимірювальних приладів и мостів, компенсаторів, ваг тощо, принцип дії яких оснований на методі порівняння, а також як вимірювальний пристрій. Узагальнена структурна схема компаратора, в якому здійснюється порівняння величини змінного струму Х (струму, напруги, потужності) з відповідною величиною постійного струму Х0, зображена на рис. 16. Основним елементом компаратора є вимірювальний (компаруючий) перетворювач ВП, який однаково реагує на величини змінного Х тa постійного Х0 струму, тобто його вихідний сигнал У не залежить від роду вхідної величини. Принцип дії компараторів здебільшошго оснований на нульовому методі порівняння, коли різниця вихідних значені вимірюваного перетворювача компаратора при подачі на його вхід значень змінного та постійного струмів зводиться під час вимірювання до нуля. Вимірювана величина змінного струму Х у положенні 1 двопозиційного перемикача S подається на вхід вимірювального перетворювача ВП, де перетворюється в сигнал Y1, який надходить на запам'ятовувальний пристрій ЗП. Потім в положенні 2 перемикача S на вхід вимірюваного перетворювача ВП подається постійний струм Х0 (струм або напруга), що перетворюється в сигнал У2, що також надходить на запам'ятовувальний пристрій ЗП. Значення постійної струму Х0 плавно змінюють до отримання рівності сигналів Y1 = Y2. Внаслідок цього значення змінного струму X дорівнює значенню постійного cтруму X0 (X = X0), яке вимірюють високоточним приладом постійного струму ВП0.
Рис.16. Узагальнена структурна схема компаратора електричних величин: ВП - вимірювальний (компаруючий) перетворювач; ЗП - запам 'ятовувальний пристрій; ВП0 - вимірювальний прилад постійного струму; - двопозіційний перемикач.
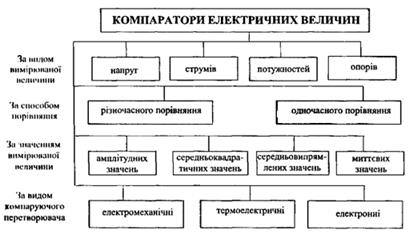
Похибка вимірювання δХ змінної величини Х за допомогою компаратора складається із похибки δ0 вимірюнаїнія величини Х0 та похибки компарування (порівняння) δК і при застосуванні сучасних компараторів становить соті частки відсотка і менше. Компаратори електричних величин класифікують за такими ознаками: за видом вимірюваної величини; за способом порівняння значень змінного і постійного струму; за значенням вимірюваної величини; за видом компенсуючого перетворювача (рис. 17). За видом вимірюваної величини всі компаратори поділяються на компаратори напруг, струмів, потужностей та електричних опорів. За способом порівняння значення змінного та постійного струму компаратори поділяються на дві групи: компаратори різночасного порівняння, в яких на один і той самий компаратори одночасного порівняння, в яких використовуються два За значенням вимірюваної нсчнчппн компаратори поділяються на такі групи: компаратори миттєвих значень х(t); амплітудних значень Xm, середньоквадратичних (діючих) значень X ти середньовипрямлених значень ХСB змінного струму X. Найпоширенішими є компаратори середньоквадратичних (діючих) значені, величин змінного струму. Це пояснюється тим, що більшість вимірювальних приладів, для метрологічної перевірки яких передовсім і були створені компаратори, градуйовані саме в діючих значеннях струму і напруги. Крім цього, оскільки середні значення потужності змінного струму визначається діючими значеннями струму і напруги, то принципи, покладені в основу побудови компараторів діючих значень струмів і напруги, можуть бути застосовані для побудови компараторів потужності. За видом компаруючого перетворювача компаратори поділяються на електромеханічні, термоелектричні та електронні. Електромеханічні компаратори, побудовані на основі вимірювальних механізмів електродинамічної ти електростатичної систем, у сучасній вимірювальній техніці практично не використовуються. Найпоширеніші термоелектричні компаратори, вимірювальні перетворювачі яких побудовані на основі термоелектричних елементів (див лекц. 9) та електронні компаратори, для побудови яких використано індуктивні подільники напруги.
Тема: Комплексные соединения. План: 1. Основные положения координационной теории. 2. Основные типы и номенклатура комплексных соединений. 3. Понятие об изомерии комплексных соединений. 4. Диссоциация комплексных соединений в растворах. 1. Ионы некоторых элементов способны присоединять к себе другие ионы или нейтральные молекулы (например, NH3), образуя более сложные комплексные ионы. При их связывании с ионами противоположного знака получаются различные комплексные соединения. Наиболее полно свойства и строение комплексных соединений объясняет координационная теория, предложенная в 1893 г. А. Вернером. Основные положения координационной теории. В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем (центральным ионом). Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряженных ионов или нейтральных молекул, называемых лигандами и образующих внутреннюю координационную сферу. Остальные ионы находятся на более далеком расстоянии от центрального иона и составляют внешнюю координационную сферу. Количество лигандов, окружающих центральный ион, называется координационным числом. Внутренняя сфера комплекса в значительной степени сохраняет стабильность в растворе (ее границы в формуле показывают квадратными скобками). Ионы внешней сферы в растворе легко отщепляются. При взаимодействии солей PtCl4 и KСl образуется комплексное соединение: PtCl4 + 2 KCl ® K2[PtCl6] (или PtCl4×2KCl) Здесь внутренняя сфера состоит из комплексообразователя Pt4+, лигандов Cl–, а внешняя сфера – из ионов K+. Координационное число (КЧ) равно 6. Диссоциация * такой соли происходит по уравнению: K2[PtCl6] ® 2 K+ + [PtCl6]2– Для установления принадлежности ионов к внешней или внутренней сфере часто пользуются реакциями ионного обмена. Например, при взаимодействии 1 моля PtCl4×4NH3 c AgNO3 осаждаются 2 моля AgCl: PtCl4×4NH3 + 2 AgNO3 ® PtCl2(NO3)2×4NH3 + 2 AgCl¯ Следовательно, два иона Cl– принадлежат к внешней, а два других – к внутренней сфере комплекса, и формула соли имеет вид: [PtCl2(NH3)4]Cl2. Анализируя координационные числа многих комплексных соединений, А. Вернер пришел к выводу, что степень окисления * центрального атома является основным фактором, влияющим на координационное число. Наиболее характерные координационные числа приведены в таблице:
Например, координационное число 6 встречается в комплексных соединениях Pt4+, Cr3+, Co3+, Fe3+, координационное число 4 – в комплексах Cu2+, Zn2+, Pd2+, Pt2+, координационное число 2 – в комплексах Ag+, Cu+. Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, в частности, его дентатностью. Лиганды, занимающие во внутренней сфере одно место, называются монодентатными. Существуют лиганды, занимающие во внутренней сфере два или несколько мест. Такие лиганды называются бидентатными или полидентатными. Например:
Координационная теория Вернера является руководящей в химии комплексных соединений и в настоящее время. С течением времени изменяются и уточняются лишь представления о силах, действующих между центральным атомом и лигандами. Широкое распространение этой теории объясняет, почему комплексные соединения часто называют «координационными соединениями». Существует ряд методов установления координационных формул комплексных соединений: С помощью реакций двойного обмена. Именно таким путем была доказана структура следующих комплексных соединений платины: PtCl4-6NH3, PtCl4-4NH3, PtCl4-2NH3, PtCl4-2KCl. Если подействовать на раствор первого соединения раствором AgN03, то весь содержащийся в нем хлор осаждается в виде хлорида серебра. Очевидно, что все четыре хлорид-иона находятся во внешней сфере и, следовательно, внутренняя сфера состоит только из молекул аммиака. Таким образом, координационная формула соединения будет [Pt(NH3)6]Cl4. В соединении PtCl4-4NH3 нитрат серебра осаждает только половину хлора, т. е. во внешней сфере находятся только два хлоридиона, а остальные два вместе с четырьмя молекулами аммиака входят в состав внутренней сферы, так что координационная формула имеет вид [Pt(NH3)4Cl2] С12. Раствор соединения PtCl4-2NH3 не дает осадка с AgN03, это соединение изображается формулой [Pt (NH3)2C14]. Наконец, из раствора соединения PtCl4-2KCl нитрат серебра тоже не осаждает AgCl, но путем обменных реакций можно установить, что в растворе имеются ионы калия. На этом основании строение его изображается формулой Кг [PtCle] - По молярной электрической проводимости разбавленных растворов. При сильном разбавлении молярная электрическая проводимость комплексного соединения определяется зарядом и числом образующихся ионов. Для соединений, содержащих комплексный ион и однозарядные катионы или анионы, имеет место следующее примерное соотношение: Измерение электрической проводимости подтверждает приведенные выше координационные формулы комплексов платины. Электрическая проводимость их изменяется. Для первого соединения ц. ж 500, что указывает на образование при его диссоциации пяти ионов и соответствует координационной формуле [Pt (NH3) 6] С14. По мере замещения во внутренней сфере молекул NH3 на ионы СЬ электрическая проводимость падает и становится минимальной для неэлектролита [Pt(NH3)2Cl4]. При переходе к соединению Кг [PtCl6] электрическая проводимость вновь возрастает, а значение ее соответствует образованию при диссоциации трех ионов. Рентгеноструктурным методом. Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурным методом. Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно. Существует и ряд других физико-химических методов установления координационных формул комплексных соединений. Анализируя координационные числа многих комплексных соединений, А. Вернер пришел к выводу, что заряд центрального иона (или, точнее, степень окисленности центрального атома) является основным фактором, влияющим на координационное число. Ниже сопоставлены наиболее характерные координационные числа в растворах и заряд центрального иона Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, его электронными свойствами. Даже для одних и тех же комплексообразователей и лигандов координационное число зависит от агрегатного состояния, от концентрации компонентов и температуры раствора. 2. Наиболее распространенной в настоящее время является классификация комплексных соединений по характеру координируемых лигандов. Однако эта классификация в полной мере применима только для тех комплексных соединений, внутренняя сфера которых состоит из одинаковых лигандов. Тем не менее она позволяет объединить комплексы в определенные группы (типы) по общности методов синтеза и некоторых физико-химических свойств. 2.1. Аквакомплексы Аквакомплексы представляют собой ионы или молекулы, в которых лигандами служат молекулы воды. В водных растворах солей почти все ионы существуют в виде акваионов, например, [Be(H2O)4]2+, [Al(H2O)6]3+, [Cr(H2O)6]3+ и т.д. При кристаллизации таких солей из водных растворов вода остается связанной с комплексообразователем: К аквакомплексам относятся многие кристаллогидраты, например, [Al(H2O)6]Cl3 (иначе – AlCl3 . 6 H2O), [Cr(H2O)6](NO3)3 (иначе – Cr(NO3)3 . 6 H2O). У некоторых кристаллогидратов часть молекул воды входит во внутреннюю, а остальные находятся во внешней сфере и связываются с внешнесферными ионами.
Координационные формулы указанных соединений, учитывающие состав внутренней и внешней сферы, таковы: · [Cu(H2O)4]SO4 . H2O и · [Ni(H2O)6]SO4 . H2O. Все аквакатионы, за исключением тех, которые образованы щелочными и щелочноземельными элементами, а также таллием(I), серебром(I) и т.п., являются катионными кислотами, в водном растворе подвергаются протолизу и создают кислотную среду (рН < 7): [Zn(H2O)4]2+ + H2O Кислотные свойства аквакомплексов выражены тем сильнее, чем выше степень окисления атома-комплексообразователя. 2.2. Гидроксокомплексы Гидроксокомплексы – комплексные соединения, содержащие в качестве лигандов гидроксид-ионы OH-. Гидроксокомплексы образуются в реакциях протолиза из аквакомплексов: [Al(H2O)6]3+ + H2O либо при растворении амфотерных гидроксидов в водных растворах гидроксидов щелочных металлов: Zn(OH)2 + 2 OH- = [Zn(OH)4]2- Водные растворы гидроксокомплексов имеют щелочную реакцию. Появление гидроксид-ионов в растворе вызвано замещением во внутренней сфере комплексов гидроксидных лигандов на молекулы воды: [Zn(OH)4]2- + H2O Гидроксокомплексы устойчивы только в сильнощелочных растворах. В нейтральной, а тем более в кислой среде, а также при нагревании растворов они разрушаются: [Al(OH)4]- + CO2 = Al(OH)3¯ + HCO3- [Be(OH)4]2- + 2NH4+ = Be(OH)2¯ + 2NH3. H2O [Zn(OH)4]2- + 4 H3O+ = [Zn(H2O)4]2+ + 4 H2O Na[Al(OH)4] = NaAlO2¯ + 2 H2O (при нагревании) Некоторые гидроксокомплексы можно использовать в качестве реагентов для идентификации отдельных ионов в растворе. Например, определение присутствия катиона Na+ иногда ведут, выделяя алорастворимый гексагидроксостибат(V) натрия Na[Sb(OH)6] в виде мелкокристаллического белого осадка по реакции: Na+ + [Sb(OH)6]- = Na[Sb(OH)6]¯ 2.3. Аммиакаты Аммиакаты – это комплексные соединения, в которых функции лигандов выполняют молекулы аммиака NH3. Более точное название комплексов, содержащих аммиак во внутренней сфере – аммины; однако молекулы NH3 могут находиться не только во внутренней, но и во внешней сфере соединения – аммиаката. Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком: AgCl(т) + 2 NH3 . H2O = [Ag(NH3)2]Cl + 2 H2O Cu(OH)2(т) + 4 NH3 . H2O = [Cu(NH3)4](OH)2 + 4 H2O NiSO4 + 6 NH3 . H2O = [Ni(NH3)6]SO4 + 6 H2O CoCl2 + 6 NH3(г) = [Co(NH3)6]Cl2 В тех случаях, когда аммиачный комплекс неустойчив в водном растворе, его можно получить в среде жидкого аммиака: AlCl3(s) + 6 NH3(ж) = [Al(NH3)6]Cl3(s) Химическая связь молекул аммиака с комплексообразователем устанавливается через атом азота, который служит донором неподеленной пары электронов. Образование амминокомплексов в водных растворах происходит путем последовательного замещения молекул воды во внутренней сфере аквакомплексов на молекулы аммиака: [Cu(H2O)4]2+ + NH3 . H2O [Cu(H2O)3(NH3)]2+ + NH3 . H2O ..... Самые устойчивые среди аммиачных комплексов: · [Co(NH3)6]3+ (b6 = 1,6 . 1035), · [Cu(NH3)4]2+ (b4 = 7,9 . 1012), · [Zn(NH3)4]2+ (b4 = 4,2 . 109) и некоторые другие. Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака, переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка: [Ni(NH3)6]Cl2 = NiCl2 + 6 NH3(г) [Cu(NH3)4]SO4 + 6 Br2 = CuSO4 + 12 HBr + 2 N2(г) [Ni(NH3)6]SO4 + 3 H2SO4 = NiSO4 + 3 (NH4)2SO4 [Cu(NH3)4](OH)2 + Na2S + 4 H2O = CuS¯ + 2 NaOH + 4 NH3 . H2O 2.4. Ацидокомплексы В ацидокомплексах лигандами служат анионы кислот, органических и неорганических: Эту группу комплексных соединений можно подразделить на две части: комплексы с кислородсодержащими лигандами и комплексы с бескислородными (преимущественно галогенидными или псевдогалогенидными) лигандами. Например, к ацидокомплексам с кислородсодержащими лигандами относятся дитиосульфатоаргентат(I)-ион, который получается по обменной реакции: Ag+ + 2 SO3S2- = [Ag(SO3S)2]3- и гексанитрокобальтат(III)-ион, который осаждается в виде мелких желтых кристаллов калиевой соли при смешивании растворов, содержащих хлорид кобальта(II), нитрит калия и уксусную кислоту: CoCl2 + 7 KNO2 + 2 CH3COOH = В этой окислительно-восстановительной реакции происходит изменение степени окисления кобальта от +II до +III. Эта реакция используется для определения примеси калия в солях натрия. Примерами ацидокомплексов с бескислородными лигандами могут служить гексахлороплатинат(IV) калия K2[PtCl6] и гексацианоферрат(II) калия K4[Fe(CN)6]. Платина химически растворяется в смеси концентрированных азотной и соляной кислот (так называемой “царской водке”) с образованием гексахлороплатината(IV) водорода H2[PtCl6]: 3 Pt + 4 HNO3 + 18 HCl = 3 H2[PtCl6] + 4 NO + 8 H2O Гексахлороплатинат(IV) водорода был первым реагентом, с применения которого началась аналитическая химия калия, рубидия и цезия, поскольку гексахлороплатинаты(IV) этих элементов K2[PtCl6], Rb2[PtCl6] и Cs2[PtCl6] малорастворимы в воде. Гексацианоферрат(II) калия образуется по реакции: 6 KCN + FeSO4 = K4[Fe(CN)6] + K2SO4 Из водного раствора гексацианоферрат(II) калия выделяется в виде желтых кристаллов состава K4[Fe(CN)6] . 3 H2O. Это соединение широко используется в аналитической практике для определения присутствия в образцах катионов железа(III): [Fe(H2O)6]3+ + K+ + [Fe(CN)6]4- = KFe[Fe(CN)6]¯ + 6 H2O Продуктом этой реакции является малорастворимый гексацианоферрат(II) железа(III)-калия KFe[Fe(CN)6] ярко-синего цвета. Для разрушения ацидокомплексов можно использовать реакции обмена лигандов, которые в случае образования более прочных комплексов идут практически до конца. Например, введение фторидсодержащего реагента в ярко-красный раствор тиоцианатного комплекса железа(III) состава [Fe(NCS)6]3- обесцвечивает его: [Fe(NCS)6]3-+ 4 F- + 2 H2O = [Fe(H2O)2F4]- + 6 NCS- b6 = 1,7 . 103; b4 = 5,5 .1015 Другой способ разрушения ацидокомплекса – связывание комплексообразователя в виде трудно растворимого осадка. Так, тетраиодомеркурат(II)-ион [HgI4]2- разрушается под действием сульфид-ионов S2-: [HgI4]2- + S2- = HgS¯ + 4 I-; ПР(HgS) = 1,4 . 10-45 2.5. Анионгалогенаты Анионгалогенаты – комплексные соединения, в которых и комплексообразователь, и лиганды представляют собой галогены. Это комплексы состава M[ЭГ¢ x Г² y ], где М – малозарядный крупный катион, например, катион щелочного металла или аммония (а также алкил- или ариламмония, фосфония, арсония и другие комплексные катионы с достаточно низкой поляризуемостью); Э – галоген-комплексообразователь, атом или молекула, обычно имеющий невысокую электроотрицательность (иод, бром, реже хлор); Г¢ и Г² - галогенидные лиганды. Степень окисления комплексообразователя Э в анионгалогенатах может быть · положительной, например, в [IIIICl4]-, · нулевой – как в [(I2)0(I3)2]2- и · отрицательной в [I-I(I2)2]-. Анионгалогенаты подразделяются на две большие группы: · изополигалогенаты (Э = Г¢ = Г²), и · гетерополигалогенаты (Э ¹ Г¢ ¹ Г²). К первой группе, например, относятся дииодоиодат(I) цезия и дибромобромат(I) рубидия – Cs[I(I)2] и Rb[Br(Br)2], Анионгалогенаты получают при взаимодействии в растворе солей-галогенидов с галогенами или межгалогенными соединениями: KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(Br)(Cl)]; 2 RbCl + I2Cl6 = 2 Rb[ICl4] Анионгалогенаты при нагревании легко разлагаются с выделением свободных галогенов или межгалогенных соединений и солей-галогенидов, причем в составе соли всегда оказывается самый электроотрицательный из галогенов: Rb[IBr2](т) = RbBr(т) + IBr(г); K[I(I)2](т) = KI(т) + I2(г) 2.6. Катионгалогены Катионгалогены – это соединения, содержащие катионы, в которых и комплексообразователь, и лиганды – галогены. Катионгалогены имеют состав [ЭГ¢ x Г² y ]Z, где Э – галоген-комплексообразователь; Г¢ и Г² - галогенидные лиганды; Z – анион типа [SbF6]-, [SbCl6]-, [AsF6]-, [BF4]- и т.п. Все катионгалогены – сильнейшие окислители. Они бурно реагируют с водой и органическими растворителями. Синтез катионгалогенов возможен только с участием сильных акцепторов галогенидных ионов в средах, не содержащих восстановителей. Растворителями и одновременно реагентами-поставщиками противоионов комплекса здесь служат соединения типа SbCl5, SbF5, PF5, BF3: ICl3 + SbCl5 = [ICl2][SbCl6] BrF3 + AsF5 = [BrF2][AsF6] В среде межгалогенных соединений анионгалогенаты и катионгалогены взаимодействуют как кислоты и основания. Например, в жидком трифториде брома идет реакция: Ag[BrF4](s) + [BrF2][SbF6](s) = Ag[SbF6](s) + 2 BrF3(ж) 2.7. Гидридные комплексы Гидридные комплексы содержат в качестве лиганда гидридный ион Н-. Комплексообразователи в гидридных комплексах чаще всего элементы IIIA-группы – бор, алюминий, галлий, индий, таллий. В ряду [BH4]- > [AlH4]- > [GaH4]- устойчивость гидридных комплексов падает. Гидридные комплексы – сильнейшие восстановители. Под действием кислот и в водной среде они разлагаются, выделяя водород: Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2 Для синтеза гидридных комплексов используют реакции: 4 NaH + B(OCH3)3 == Na[BH4] + 3 CH3ONa (при 250 °C) 4 LiH + AlCl3 = Li[AlH4] + 3 LiCl 3 Li[BH4] + AlCl3 = Al[BH4]3 + 3 LiCl NaBO2 + Al + Na + 2 H2 = Na[BH4] + NaAlO2 Последнюю из указанных реакций ведут в автоклаве под давлением 5-10 атм. Тетрагидридоборат алюминия Al[BH4]3 – самое летучее из всех известных соединений алюминия (температура кипения Al[BH4]3 равна 44,5 °С); на воздухе самовоспламеняется, а с водой энергично взаимодействует: Al[BH4]3 + 12 H2O = 3B(OH)3 + Al(OH)3 + 12 H2 2.8. Карбонильные комплексы. Комплексные соединения, в которых лигандом является карбонил – монооксид углерода СО, называются карбонильными. Степень окисления металла в комплексных карбонилах, как правило, нулевая. Карбонильные комплексы в обычных условиях – кристаллические вещества или жидкости, легколетучие и обладающими низкими температурами плавления и кипения:
Карбонильные комплексы d -элементов, как правило, диамагнитны. Они практически нерастворимы в воде и относятся к категории неэлектролитов, но хорошо растворимы в органических растворителях; так же, как монооксид углерода, они весьма токсичны. Значения координационного числа центральных атомов в карбонильных комплексах можно определить с помощью правила Сиджвика. В соответствии с этим правилом при образовании карбонильных (и не только карбонильных) комплексов вокруг металла создается устойчивая внешняя 18-электронная оболочка из s -, p - и d -электронов комплексообразователя и электронных пар лигандов. Например, атом железа(0) имеет конфигурацию [Ar] 3 d 64 s 2, т.е. восемь внешних (валентных) электронов. Для образования устойчивой 18 электронной конфигурации недостает (18 – 8) = 10 электронов. Эти 10 электронов (5 электронных пар) центральный атом Fe0 получает от пяти молекул CO, каждая из которых является донором одной электронной пары. Точно так же для никеля(0) с конфигурацией [Ar] 3 d 84 s 2 до устойчивой конфигурации не будет хватать (18 – 10) = 8 электронов, а число карбонильных лигандов составит 8/2 = 4. Формула комплекса [Ni(CO)4] (тетракарбонилникель). Более сложный для рассмотрения случай – карбонильный комплекс кобальта(0). Центральному атому Co0 с электронной конфигурацией [Ar] 3 d 74 s 2 до устойчивой конфигурации не будет хватать (18 – 9) = 9 электронов. Число предполагаемых карбонильных лигандов: 9/2 = 4,5(?!). Помимо димеризации, образование устойчивой 18-электронной оболочки может быть достигнуто при образовании карбонильного комплексного иона. Например, для ванадия(0) с электронной конфигурацией [Ar] 3 d 34s2 до устойчивой конфигурации не будет хватать (18 – 5) = 13 электронов. Карбонильные лиганды передадут атому ванадия 6 ´ 2 = 12 электронов, и получится неустойчивый комплекс – радикал состава [· V(CO)6], содержащий 17 электронов. Упрочнение комплекса за счет превращения электронной оболочки в 18-электронную будет достигаться превращением ванадия(0) в ванадий(-I) при образовании гексакарбонилванадата(-I) калия состава K[V(CO)6]. Карбонильные комплексы часто получают прямым синтезом: Fe(т) + 5 CO(г) = [Fe(CO)5](ж) (при 200 °С и 150 атм) При нагревании карбонилы разлагаются: [Fe(CO)5](ж) = Fe(т) + 5 CO(г) (при 300 °С) Карбонильные комплексы, растворенные в тетрахлориде углерода, энергично взаимодействуют с галогенами, а кислоты реагируют с карбонилами, как с соответствующими металлами: 2 [Fe(CO)5] + 3 Cl2 = 2 FeCl3 + 10 CO [Ni(CO)4] + Br2 = NiBr2 + 4 CO [Fe(CO)5] + H2SO4 = FeSO4 + 5 CO + H2 2.9. p-комплексы p-комплексы (пи-комплексы) – это комплексные соединения, в которых в роли лигандов фигурируют ненасыщенные органические молекулы типа этилена, циклопентадиена, бензола и т.п. Наиболее известным примером таких комплексов служит ферроцен – бис(циклопентадиенил)железо состава [Fe(C5H5)2]. Циклопентадиен С5H6 – соединение с двумя двойными связями. Он является очень слабой кислотой. При взаимодействии с металлическим натрием образуется циклопентадиенилнатрий Na(C5H5) с анионом С5Н5-: 2 Na + 2 С5H6 = 2 Na(C5H5) + H2 При действии циклопентадиенилнатрия Na(C5H5) на соль железа(II) в среде тетрагидрофурана выделяются оранжевые кристаллы бис(циклопентадиенил)железа: FeCl2 + 2 Na(C5H5) = [Fe(C5H5)2] + 2 NaCl Структура этого соединения напоминает сэндвич или бутерброд:
Комплекс диамагнитен, а комплексообразователь – Fe(II) находится между циклическими анионами С5Н5- на равном расстоянии от всех атомов углерода. Выделить в бис(циклопентадиенил)железе отдельные ковалентные связи между комплексообразователем и атомами лиганда нельзя: центральный атом образует связь со всей p-электронной системой лиганда. В частице ферроцена донором электронных пар являются циклопентадиенил-ионы, каждый из которых предоставляет по три пары p-электронов. Акцепторами этих электронных пар служат sp 3 d 2-гибридные орбитали железа(II). Поскольку образуются шесть многоцентровых связей, которые упрочняются по дативному механизму (за счет электронных пар атома железа), валентные штрихи, обозначающие связь металл – лиганд, теряют свой обычный смысл. Следовательно, к p-комплексам относят те комплексы, у которых в образовании связи M – L участвуют p-электроны всего лиганда, а не какого-либо отдельного атома. 2.10. Хелаты Хелаты, или циклические комплексные соединения. Хелатами называют комплексные соединения, внутрення сфера которых состоит из циклических группировок, включающих комплексообразователь. Например, a-аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде: Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2 H2O Лиганд NH2CH2COO- (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной группы и через атом азота аминогруппы:
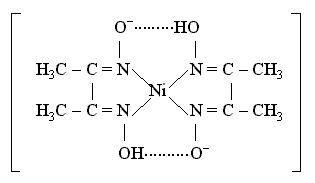
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла, в связи с чем полученный комплекс отличается высокой устойчивостью. Константа образования диглицинатомеди(II) b2 равна 1,8 . 1015. Важное значение в химико-аналитической практике имеет открытая Л. А. Чугаевым реакция взаимодействия диметилглиоксима с катионами никеля(II) в аммиачной среде, приводящая к образованию малорастворимого ярко-красного комплексного соединения - бис(диметилглиоксимато)никеля(II)
Функции лиганда в этом комплексном соединении выполняет диметилглиоксимат-анион
образующий две химические связи с комплексообразователем, вследствие чего получаются два пятичленных циклических фрагмента, упрочняющих комплекс. Строение получаемого хелата плоское; благодаря внутримолекулярным водородным связям (между лигандами) образуются еще две шестичленные циклические группировки, включающие атомы никеля и стабилизирующие частицу комплекса. Реакция Чугаева очень чувствительна и селективна по отношению к катионам никеля(II) и позволяют уверенно определить его присутствие в любых химических объектах, а получаемый хелатный комплекс используется как пигмент. 3.
Многообразие координационных соединений обусловлено образованием изомеров – соединений одинаковых по составу, но отличающихся расположением лигандов вокруг центрального атома. Гидратная (сольватная) изомерия обусловлена различным расположением молекул воды и анионных лигандов между внутренней и внешней сферами. Например, CrCl3∙6H2O существует по крайней мере в трех изомерных формах:
|






 [Zn(H2O)3(OH)]+ + H3O+
[Zn(H2O)3(OH)]+ + H3O+