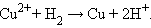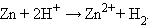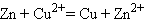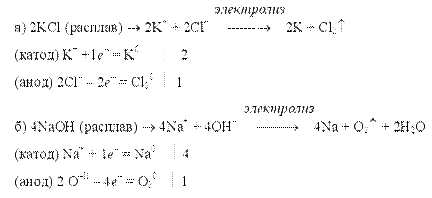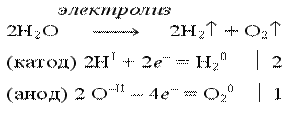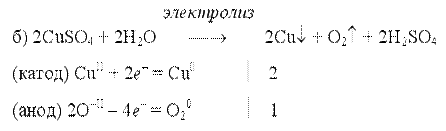Метод полуреакций
Н2S → S + 2H+ Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства: Н2S - 2е- = S + 2H+ Это первая полуреакция - процесс окисления восстановителя Н2S. Обесцвечивание раствора связано с переходом иона MnO4- (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой MnO4- → Mn2+ В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так: MnO4- + 8Н+→ Мn2+ + 4Н2О Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов: MnO4- + 8Н+ + 5e-= Mn2+ + 4Н2О Это вторая полуреакция - процесс восстановления окислителя, т.е. перманганат-иона Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так: И, сократив на 10Н+, окончательно получим 5Н2S + 2MnO4- + 6H+ = 5S + 2Mn2+ + 8Н2О Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены. Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону - анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы: Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса. Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его.Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах. 3. ЭЛЕКТРОХИМИЯ, раздел физ. химии, который изучает системы, содержащие ионы (р-ры, расплавы и твердые электролиты), а также процессы и явления с участием заряженных частиц (ионов и электронов), имеющие место на границе раздела двух фаз. Обычно одной из фаз является металл или полупроводник, другая фаза - р-р или расплав электролита либо твердый электролит. Для таких двухфазных систем термин "Э." имеет более узкий смысл как наука, изучающая взаимод. зарядов металла или полупроводника с ионами и молекулами р-ра (расплава, твердого электролита). Часто это взаимод. сопровождается возникновением в цепи электрич. тока, тогда Э. можно определить как науку, изучающую физ.-хим. процессы, которые сопровождаются появлением электрич. тока или, наоборот, возникают под действием электрич. тока на хим. соединения. Последнее определение широко распространено, хотя и является наиб. узким.
3.1 Проводники первого рода (твердые) и второго рода (жидкие электролиты) совместно используются в гальванических элементах, служащих источниками постоянного тока. В гальванических элементах во время их работы происходит движение ионов и оседание на электродах элемента, выделяющегося из электролита вещества. Простейшим гальваническим элементом является медно-цинковый. В стеклянный сосуд,, наполненный раствором серной кислоты H2SO4 в воде Н20, погружены медная Cu и цинковая Zn пластины, которые представляют собой положительный и отрицательный полюсы элемента. При замыкании цепи элемента каким-либо проводником внутри этого элемента будет протекать ток от цинковой отрицательной пластины к медной положительной, а во внешней цепи — от медной к цинковой. Под действием тока внутри элемента положительные ионы водорода Н2 движутся по направлению тока, отрицательные ионы кислотного остатка SO4 — в противоположном направлении. Приходя в соприкосновение с медной пластиной, положительные ионы водорода отдают ей свои заряды, а водород в виде пузырьков газа скопляется на ее поверхности. В это же время отрицательные ионы остатка серной кислоты отдают свои заряды цинковой пластине. Таким образом происходит непрерывный заряд пластин элемента, поддерживающий разность потенциалов (напряжение) на его зажимах. Выделение водорода на медной пластине элемента ослабляет его действие, поляризует элемент. Явление поляризации состоит в том, что скопляющийся на положительном электроде водород создает в совокупности с металлом электрода дополнительную разность потенциалов, называемую электродвижущей силой поляризации. Эта э. д. с. направлена противоположно электродвижущей силе элемента. Кроме того, пузырьки водорода, покрывающие часть медной пластины, уменьшают ее действующую поверхность, а это увеличивает внутреннее сопротивление элемента. Поляризация в рассмотренном элементе настолько значительна, что делает его непригодным для практических целей. Устранение явления поляризации в современных элементах осуществляется посредством поглотителей, вводимых в состав элемента и носящих название деполяризаторов, которые предназначены для поглощения водорода и не допускают скопления его на положительном полюсе элемента. Такими деполяризаторами могут служить химические препараты, богатые кислородом или хлором. Э. д. с. гальванического элемента зависит от химических и физических свойств веществ, его составляющих и, как показывает опыт, не зависит ни от формы и размеров элемента, ни от его внутреннего устройства. Но внутреннее устройство и размеры отдельных частей элемента имеют большое влияние на величину его внутреннего сопротивления, так как они зависят от расстояния между полюсами (при уменьшении этого расстояния внутреннее сопротивление элемента уменьшается), от размера погруженной в жидкость поверхности полюсов (при увеличении этой поверхности внутреннее сопротивление уменьшается), от химического состава жидкости элемента. Необходимо отметить, что внутреннее сопротивление гальванических элементов не является величиной постоянной (по мере работы элемента оно постепенно возрастает). В зависимости от способа деполяризации гальванические элементы могут быть подразделены на два типа: элементы, в которых в качестве деполяризатора применяют раствор какой-либо соли, например медно-цинковые, и элементы, в которых анод окружен перекисью марганца, например, угольно-цинковые. Гальванические элементы указанных двух типов широко применяют в электротехнике.
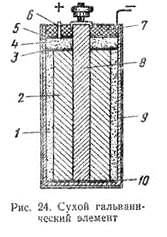
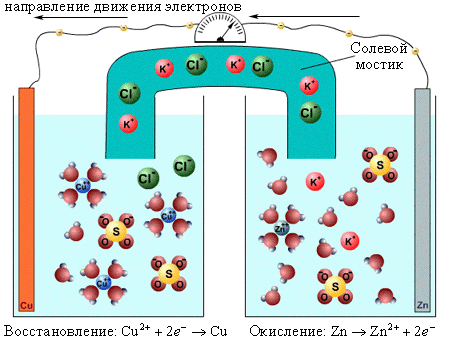
Э. д. с. медно-цинкового элемента равна 1,1 в, а внутреннее сопротивление в зависимости от времени работы — 5 - 10 ом. В угольно-цинковом элементе положительным полюсом служит угольная пластина, а отрицательным — цинковый стержень. Деполяризатором в этом элементе является спрессованная под большим давлением смесь, называемая агломератом. Она состоит из перекиси марганца и графита. В качестве электролита в угольно-цинковом элементе применяют водный раствор хлористого аммония NН4Cl. Электродвижущая сила угольно-цинкового элемента 1,4—1,5 в в начале разряда при среднем значении 0,9 - 1,1 в, а внутреннее сопротивление в зависимости от конструкции элемента— 0,25 -0,7 ом в начале разряда и 1,4—5 ом в конце. Угольно-цинковые элементы выпускает отечественная промышленность в виде так называемых сухих элементов стаканчикового и галетного типов, весьма удобных для переноски и перевозки. В сухих элементах стаканчикового типа (рис. 24) положительный полюс 8 с агломератом 2 помещают внутри цинковой коробки 9, которая служит отрицательным полюсом элемента. Пространство между стенками цинковой коробки и агломератом заполняют, пастой 1, состоящей из раствора хлористого аммония и картофельной муки. Над агломератом укладывают картонную прокладку 3,1 на которую насыпают прослойку 4 из опилок; сверху опилки закрывают картонной прокладкой 5. Затем элемент заливают смолой 7, в которую вставляют трубку 6. Назначение этой трубки — удалять образующиеся внутри элемента газы. На выходящий из смолы угольный электрод насаживают медный колпачок с винтом и гайкой для присоединения проводника. К верхней части цинковой коробки (отрицательному полюсу) припаивают изолированный гибкий проводник. На дно коробки укладывают изолирующую прокладку 10. В галетном элементе отрицательным электродом является цинковая пластина, положительным — спрессованный в виде галеты порошок двуокиси марганца с углем. Между электродами помещают картонную пластинку, пропитанную раствором нашатырного спирта. Наружная поверхность цинковой пластины покрыта слоем канифоли с частицами графита для электропроводности. В качестве изоляции используются хлорвиниловые пленки. Галетные элементы компактны и их активные материалы (особенно цинк) используются лучше, чем в стаканчиковых элементах. В окисно-ртутных элементах отрицательным электродом является цинк, а положительным — окись ртути. Их преимущество по сравнению с угольно-цинковыми элементами состоит в хорошей сохранности при повышенной температуре, меньшем изменении напряжения при разряде и большой удельной энергии на единицу объема, что особенно ценно для использования в переносной аппаратуре в условиях теплого климата. В настоящее время широко применяют элементы ВДЛ, электродами которых служит цинк и активированный пористый уголь, адсорбирующий кислород из воздуха, а электролитом — раствор едкого калия. Достоинство этих элементов - малое изменение напряжения при разряде. Вследствие герметичности элементов ВДЛ не происходит заметного ухудшения свойств едкого калия, поэтому они могут храниться неограниченное время. После полного разряда элемента угольный электрод сохраняет работоспособность и элемент может быть восстановлен путем замены цинка и электролита. Такое восстановление элемента можно производить дважды. Э. д. с. элемента ВДЛ 1,4 в, напряжение при нормальном режиме разряда 1,2—1,25 в, напряжение в конце разряда 0,9 в. Ввиду дефицитности и высокой стоимости цинка желательно использовать в качестве отрицательного электрода какой-либо другой металл, например железо. В последние годы разработаны железо-угольные щелочные элементы ВДЖ, применяемые для питания радиоустройств в трудно доступных для обслуживания местностях. Однако замена цинка железом привела к уменьшению э. д. с. элемента. Начальное напряжение элемента ВДЖ 0,75 в, напряжение в конце разряда 0,45 в. Элементы ВДЖ выдерживают длительное хранение и нормально работают при температуре 0° С, Для составления батарей гальванические элементы соединяют между собой последовательно, параллельно и смешанно. При последовательном соединении положительный полюс первого элемента соединяется с отрицательным полюсом второго элемента, положительный полюс второго — с отрицательным третьего и т. д. Если батарея состоит из n последовательно соединенных элементов с э. д. с. каждого элемента Е0 и с внутренним сопротивлением r0 ом, то э. д. с. батареи Е=nЕ0, а внутреннее сопротивление ее r = nr0 При параллельном соединении элементов положительные полюсы всех элементов соединяют между собой и отрицательные полюсы также соединяют между собой. В результате получают два общих полюса батареи: положительный и отрицательный. Если батарея состоит из m параллельно соединенных элементов с э. д. с. Каждого элемента E0 в и с внутренним сопротивлением r0 ом, то э. д. с. батареи Е = Е0, а внутреннее сопротивление ее Для составления батареи из смешанно соединенных элементов разделяют все элементы на группы с одинаковым числом их в каждой группе. Элементы в каждой группе соединяют параллельно или последовательно, а группы между собой в первом случае — последовательно, а во втором — параллельно. Если n — число групп или элементов в группе, соединенных поcледовательно, m — число групп или элементов в группе, соединении параллельно, Е0 — э. д. с. каждого элемента, а r0 —внутреннее сопротивление, то э. д. с. батареи Е = nЕ0, а ее внутреннее сопротивление 3.2 Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка (рис. 7.1) – представляет собой сосуды, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода *), представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС). В проводниках второго рода носителями заряда служат ионы, в отличие от электронов в проводниках первого рода. Реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля–Якоби, схема которого
отражает современную систему обозначений для гальванических элементов. Слева записывается анод Zn¦Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Cu2+¦Cu – электрод с недостатком электронов, положительный полюс (+). Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
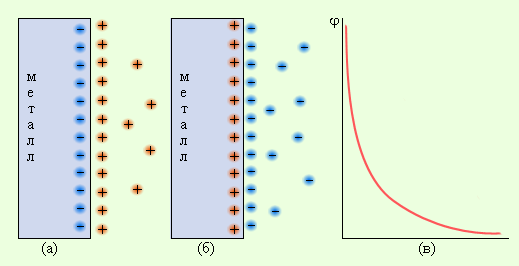
Электроны по внешнему участку цепи, металлическому проводнику, переходят от отрицательного полюса к положительному. Внешнюю цепь на схеме не изображают. В круглых скобках знаками плюс и минус обозначают полюсы электродов. Рассмотрим системы металл–растворитель и металл–электролит. В этих гетерогенных системах в зависимости от природы металла и электролита возможен переход ионов металла в раствор или ионов металла из раствора на поверхность металла. Эти процессы определяются отношением энтальпии отрыва иона от кристаллической решетки металла (ΔHреш) и энтальпии сольватации этого иона Mn+ ∙ solv(ΔHsolv). В результате на фазовой границе металл–электролит устанавливается равновесие:
Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо, что приводит к отрицательному заряду на металле по отношению к раствору. Если малоактивный металл погружен в раствор соли с концентрацией больше равновесной, то происходит переход ионов из раствора на металл, заряженный положительно (рис. 7.2). В любом случае возникает двойной электрический слой, и появляется разность электрических потенциалов, или гальвани-потенциал. Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды в электрохимии – это системы из двух токопроводящих тел: проводников 1 и 2 рода. Абсолютное значение разности потенциалов на границе двух фаз разной природы металл│электролит измерить нельзя, однако можно измерить разность потенциалов двух различных электродов.
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K
Платиновая чернь адсорбирует водород, который электрохимически взаимодействует с H+ по уравнению
Для гальванического элемента
в котором протекает окислительно-восстановительная реакция
запишем уравнение изотермы
Учитывая, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а ΔG = –nFE, после преобразования получим уравнение Нернста для электродного процесса:
В этом уравнении Уравнение (7.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода. Отметив, что
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста:
Активность твердого вещества (aтв) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода (aM) уравнение Нернста упрощается:
Потенциал электрода, как видно из этого уравнения, зависит от активности ионов Следует подчеркнуть, что: 1. Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная. 2. В дробном индексе при E и E° над чертой ставится окисленная форма полуэлемента, под чертой – восстановленная. 3. Активности твердых веществ в уравнение Нернста не входят. Значения некоторых стандартных окислительно-восстановительных потенциалов гальванических элементов, расположенных в порядке их возрастания, представлены в таб. 7.1. Положительный окислительно-восстановительный потенциал электрода Cu2+│Cu (E° = +0,34 B) показывает, что в стандартных условиях водород окисляется ионами меди, медный электрод по отношению к водороду является катодом, электроны по внешней цепи переходят от водорода к меди:
Отрицательный потенциал Zn2+│Zn (E° = –0,76 B) означает, что в стандартных условиях цинковый электрод может быть только анодом, его окислительные функции по отношению к водородному электроду 2H+│H2 отрицательные. Цинк здесь восстанавливает катионы водорода, электроны во внешней цепи перетекают от цинка к водороду:
Суммируя эти реакции, получим
то есть электрод с более положительным значением стандартного электродного потенциала является окислителем по отношению к электроду с менее положительным значением E 3.3 Совокупность ОВР, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом. На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является «восстановителем». На аноде происходит отдача электронов анионами, поэтому анод является «окислителем». При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы. При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и восстановительных процесса: на аноде — окисление анионов и гидроксид-ионов, на катоде — восстановление катионов и ионов водорода. При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода; на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении При выборе наиболее вероятного процесса на аноде и катоде исходят из положения, что протекает та реакция, которая требует наименьшей затраты энергии. При электролизе растворов солей с инертным электродом используют следующие правила. 1. На аноде могут образовываться следующие продукты: а) при электролизе растворов, содержащих анионы F-, SО42-, NO3-, РO43-, ОН- выделяется кислород; б) при окислении галогенид-ионов выделяются свободные галогены; в) при окислении анионов органических кислот происходит процесс: 2RCOO- - 2е → R-R + 2СО2. 2.При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен правее водорода, то выделяется металл. 3.При электролизе растворов солей, содержащих ионы, расположенные между Аl3+ и Н+ на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода. Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных электродах. В растворе находятся ионы Cu2+ и Cl-, которые под действием электрического тока направляются к соответствующим электродам: <>
На катоде выделяется металлическая медь, на аноде — газообразный хлор. Если в рассмотренном примере электролиза раствора СuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl и выделения хлора протекает окисление анода (меди). В этом случае происходит растворение самого анода, и в виде ионов Сu2+ он переходит в раствор. Электролиз СuCl2 с растворимым анодом можно записать так:
Таким образом, электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений. Для получения высокоактивных металлов (калия, алюминия и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей или оксидов, например <>
При электролизе водного раствора соли активного металла кислородсодержащей кислоты (например, КNО3) ни катионы металла, ни ионы кислотного остатка не разряжаются. На катоде выделяется водород, а на аноде — кислород, и электролиз раствора нитрата калия сводится к электролитическому разложению воды. Отметим, что электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как электролиты плавятся при очень высоких температурах. Зависимость количества вещества, образовавшегося при электролизе, от времени и силы тока описывается обобщенным законом Фарадея: m = (Э / F) • I • t = (М / (n • F)) • I • t, где m — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль); М — молярная масса вещества (г/моль); n — количество отдаваемых или принимаем электронов; I — сила тока (А); t — продолжительность процесса (с); F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F= 96500 Кл/ моль = 26,8 А• ч / моль) Примеры электролиза расплавов:
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например Li+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O−II анионов оксокислот с элементом в высшей степени окисления (например ClO4−, SO42−, NO3−, PO43−, CO32−, SiO44−, MnO4−), вместо них окисляется вода . Примеры электролиза растворов солей:
(на аноде окисляются анионы Сl−, а не кислород O−II молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород)
(на катоде восстанавливаются катионы Cu2+, а не водород HI молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем HI в воде). 4. Электролиз находит весьма широкое применение. Для защиты металлических изделий от коррозии на их поверхность наносится тончайший слой другого металла — хрома, серебра, золота, меди, никеля и т.д. Иногда применяют многослойное покрытие. Например, внешние детали автомобиля сначала покрывают тонким слоем меди, на медь наносят тончайший слой никеля, а на него — слой хрома. Майкл Фарадей (1791 — 1867) — один из крупнейших английских физиков и химиков. Большая часть его работ относится к области электричества. Он установил законы электролиза, открыл явление электромагнитной индукции. Впервые получил в жидком виде ряд газов (хлор, аммиак и др.). Он открыл бензол и изобутилен.
|

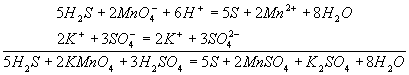 Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса: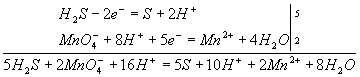
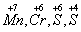 а есть ионы
а есть ионы 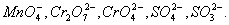
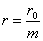
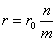 .
.
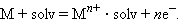
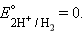
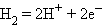
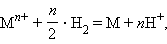
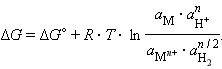
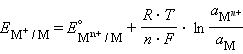
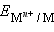 – ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея.
– ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея.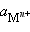 – активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
– активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде: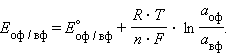
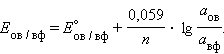
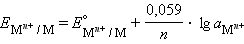
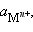 которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E°.
которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E°.