Основные формулы. NA – постоянная Авогадро,
Количество вещества где N – число молекул, NA – постоянная Авогадро, m – масса вещества, M – молярная масса.
Уравнение Менделеева- Клайперона
где р – давление газа, V – его объем, R – молярная газовая постоянная, T – термодинамическая температура.
Уравнение молекулярно – кинетической теории газов
где n 0 – концентрация молекул, < E пост> – средняя кинетическая энергия поступательного движения молекул, m 0 – масса молекулы, < υ;кв> – средняя квадратичная скорость.
Средняя кинетическая энергия молекулы
где i – число степеней свободы, k – постоянная Больцмана.
Внутренняя энергия идеального газа
Скорости молекул: средняя квадратичная средняя арифметическая наиболее вероятная
Средняя длина свободного пробега молекулы
где d – эффективный диаметр молекулы.
Среднее число столкновений молекулы в единицу времени
Уравнение диффузии
где D – коэффициент диффузии, Ρ – плотность, dS – элементарная площадка, перпендикулярная к оси Х.
Уравнение теплопроводности
где χ – коэффициент теплопроводности.
Сила внутреннего трения гдеη – динамическая вязкость.
Коэффициент диффузии
Вязкость (динамическая)
Теплопроводность где сV - удельная изохорная теплоемкость.
Молярная теплоемкость идеального газа: Изохорная Изобарная
Первое начало термодинамики
Работа расширения газа при процессе: Изобарном Изотермическом адиабатном
где
Уравнение Пуассона (уравнение адиабатного процесса)
Коэффициент полезного действия цикла Карно
где Q и T – количество теплоты, полученное от нагревателя, и его температура, Q 0 и T 0 – количество теплоты, переданное холодильнику, и его температура. Изменение энтропии при переходе из состояния 1 в состояние 2
Уравнение Ван - дер - Ваальса: для 1 моль газа для ν моль газа где a и b – постоянные Ван - дер - Ваальса, VM – объем 1 литра газа.
Критические параметры
Собственный объем молекулы
Высота поднятия жидкости в капилляре радиусом r
|

 ,
, ,
,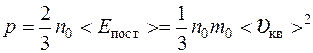 ,
, ,
, .
. ,
, ,
,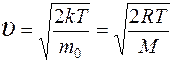 .
. ,
, .
. ,
, ,
, ,
, .
.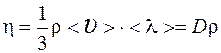 .
. ,
, ,
, .
.
 ,
, ,
, ,
, .
. ,
,  ,
,  .
. ,
,
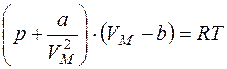 ,
, ,
, .
. .
. .
.


