Молекулярно-кинетическая теория идеальных газов
Задача 1. Определить, сколько киломолей и молекул водорода содержится в объеме 50 м3 под давлением 767 мм рт. ст. при температуре 18°С. Какова плотность и удельный объем газа?
можно определить ν:
Число молекул N, содержащихся в данном объеме, находим, используя число Авогадро NА (которое определяет какое количество молекул содержится в одном киломоле). Общее количество молекул, находящихся в массе m данного газа, может быть установлено, так как известно число молей ν.
Подставляя в формулу число киломолей, устанавливаем число молекул, содержащихся в объеме V: Плотность газа ρ = m / V определяем из уравнения Менделеева - Клайперона:
Подставляя числовые значения в единицах СИ в формулу, определим плотность газа:
Удельный объем газа d определяем из уравнения Менделеева - Клайперона:

Ответ: 11,9 м3/кг.
Задача 2. В сосуде объемом 2 м3 находится смесь 4 кг гелия и 2 кг водорода при температуре 27°С. Определить давление и молярную массу смеси газов.
М 1 – егомолярная масса; V – объем сосуда; Т – температура газа; R = 8,31 Дж/(моль·К) –молярная газовая постоянная; р 2 – парциальное давление водорода; m 2 – масса водорода; М 2 – его молярная масса. По закону Дальтона: Из уравнений (1) и (2) выразим р 1и р 2и подставим в уравнение (3):
С другой стороны, уравнение Менделеева - Клайперона для смеси газов имеет вид:
Сравнивая (4) и (5) найдем молярную массу смеси газов по формуле:
где ν1 и ν2 – число молей гелия и водорода соответственно.

Ответ: 3·10-3 кг/моль.
Задача 3. При каком давлении средняя длина свободного пробега молекул водорода <;λ > = 2,5 см при температуре 68°С? Диаметр молекул водорода принять равным d = 2,3·10 –10 м.
Это проводится следующим образом:
где NA – число Авогадро и k – постоянная Больцмана. Следовательно, Число молекул в 1 м3 выразим через среднюю длину свободного пробега. Из формулы

Ответ: 0,8 Па.
Задача 4. Определить плотность разреженного азота, если средняя длина свободного пробега молекул 10 см. Какова концентрация молекул?
где d – эффективный диаметр молекул (для азота d = 0,31·10 –9 м). Концентрацию молекул найдем из равенства:
где NA – число Авогадро; М = 28·10 –3 кг/моль – молярная масса азота. Решая совместно уравнения (1) и (2), находим:

Ответ: 1,09·10-6 кг/м3.
Задача 5. Вычислить коэффициент внутреннего трения и коэффициент диффузии кислорода, находящегося при давлении 0,2 МПа и температуре 280 К.
где ρ– плотность газа; < λ > – средняя длина свободного пробега молекул; <υ;ар >; – средняя арифметическая скорость молекул. Из (1) и (2) следует Среднюю арифметическую скорость и среднюю длину свободного пробега молекул находим по формулам:
где R = 8,31 Дж/(моль·К) – молярная газовая постоянная; Т – термодинамическая температура; d = 2,9·10 –10 м – эффективный диаметр молекулы кислорода; n 0 – число молекул в 1 м3 (концентрация). Из уравнения Менделеева - Клайперона определяем n 0 (см. задачу 3): где р – давление; k = 1,38·10 –23 Дж/К – постоянная Больцмана. Подставляя (6) в уравнение (5), получаем: Окончательный вид расчетной формулы для коэффициента диффузии найдем, подставляя выражения (4) и (7) в уравнение (2):
Плотность кислорода определяется по формуле: Подставляя (9) и (8) в (3), получаем расчетную формулу для коэффициента внутреннего трения: Вычисляем:
Ответ:
Задача 6. Наружная поверхность кирпичной стены площадью 25 м2 и толщиной 37 см имеет температуру 259 К, а внутренняя поверхность–293 К. Помещение отапливается электроплитой. Определить ее мощность, если температура в помещении поддерживается постоянной. Теплопроводность кирпича 0,4 Вт/(м·К).
За время t – электроплита должна выделить такое же количество теплоты: Приравнивая правые части уравнений (1) и (2), получаем:
откуда Ответ: 0,92 кВт.
2. Основы термодинамики
Задача 7. Чему равны средние кинетические энергии поступательного и вращательного движения молекул, содержащихся в 2 кг водорода при температуре 400 К.
число степенейсвободы молекулы водорода равно 5. В среднем на одну степень свободы приходится энергия:
Число молекул, содержащихся в массе газа m: где R = kNA – молярная газовая постоянная. Средняя кинетическая энергия вращательного движения молекул водорода: Подставляя числовые значения и формулы (1) и (2), имеем:
Ответ: 4986 кДж, 3324 кДж.
Задача 8. При адиабатическом сжатии давление воздуха было увеличено от Р 1 = 100 кПа до Р 2 = 1 МПа. Затем при неизменном объеме температура воздуха была понижена до первоначальной. Определить давление Р 3 газа в конце процесса.
Процесс адиабатического сжатия 1-2 совершается без теплообмена и согласно уравнению Пуассона:
Макроскопические параметры P, V, T воздуха в состоянии 1, 2, 3 связаны соотношением:
откуда P 1 V 1 = P 3 V 3. По условию задачи V 2 = V 3.Используя уравнение (1) можно записать
Тогда Ответ: Задача 9. Вычислить массу столба воздуха высотой 1 км и сечением 1 м2, если плотность воздуха у поверхности Земли
Продифференцировав (1), получим С другой стороны убыль давления dP при переходе от высоты h 0 к высоте h 0 + dh
где Используя уравнения (2) и (3) получим:
или
Вычислим массу столба воздуха
Подставив данные, приведенные в условии задачи получим: m = 1,13 · 103 кг. Ответ: m = 1,13 · 103 кг.
Задача 10. Определить скорость вылета поршня массой 4 кг из цилиндра при адиабатном расширении кислорода в 40 раз, если начальное давление воздуха 107 Па, а объем 0,3 л.
где т и υ – масса и скорость поршня. Для подсчета работы адиабатически расширяющегося газа воспользуемся формулой:
Ответ: 54 м/с.
Задача 11. Молекулярный пучок кислорода ударяется о неподвижную стенку. После соударения молекулы отражаются от стенки с той же по модулю скоростью. Определить давление пучка на стенку, если скорость молекул 500 м/с и концентрация молекул в пучке 5·10 24 м -3.
где F – сила давления, S – площадь. Силу давления найдем из второго закона Ньютона:
где m – масса кислорода, ударившегося о стенку за время t, Δ υ; – изменение скорости молекул при ударе. Массу одной молекулы кислорода найдем из закона Авогадро: За время t о стенку ударяются молекулы, находящиеся в объеме: Изменение скорости при соударении: Подставляя выражения (3), (4) в (2), находим: Ответ: 1,33·105 Па.
Задача 12. Определить удельные теплоемкости ср, сv, для смеси 1 кг азота и 1 кг гелия.
происходит нагревание. Если нагревание происходит при постоянном объеме, то: Окончательно получим: Если нагревание происходит при постоянном давлении, то
где
Подставляя это значение в уравнение (2), получим:
Произведем вычисления:
Ответ:
Задача 13. В цилиндре под поршнем находится водород, который имеет массу 0,02 кг и начальную температуру 27°С. Водород сначала расширился адиабатически, увеличив свой объем в 5 раз, а затем был сжат изотермически, причем объем газа уменьшился в 5 раз. Найти температуру в конце адиабатического расширения и работу, совершаемую газом. Изобразить процесс графически.
постоянном давлении и постоянном объеме. Для водорода γ = 1,4. Отсюда выражение для конечной температуры Т 2 будет:
Работа А 1 газа при адиабатическом расширении равна изменению внутренней энергии:

Работа А 2 газа при изотермическом процессе может быть выражена в виде:
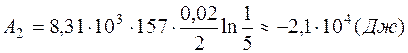 . .
Знак «минус» показывает, что при сжатии газа работа совершается над газом внешними силами. Полная работа, совершенная газом при описанных процессах, равна:
 . .
График процесса приведен на рисунке 1.
Ответ: 8,7 · 103 Дж.
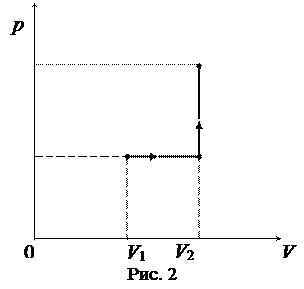
Задача 14. Кислород массой m = 2 кг занимает объем V 1= 1 м3 и находится под давлением р 1= 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V 2= 3 м3, а затем при постоянном объеме до давления р 3= 0,5 МПа. Найти изменение Δ U внутренней энергии газа, совершенную им работу А и количество теплоты Q, переданное газу. Построить график процесса.
Начальную и конечную температуры найдем, используя уравнение Менделеева - Клайперона:
Решая его относительно Т, получим:
Подставляя в выражение (1) числовые значения входящих в него
величин, находим: Работа расширения газа при постоянномдавлении выражается формулой:
Работа газа, нагреваемого при постоянном объеме, равна нулю, т.е. А 2 = 0. Следовательно, полная работа, совершенная газом, равна: График процесса приведен на рисунке 2.
Ответ: 3,65 МДж.
Задача 15. Идеальный двухатомный газ, содержащий количество вещества n = 1 моль и находящийся под давлением Р 1 = 0,1 МПа при температуре Т 1 = 300 К, нагревают при постоянном объеме до давления Р 2 = 0,2 МПа. После этого газ изотермически расширялся до начального давления и затем изобарно был сжат до начального объема V 1. Построить график цикла. Определить температуру Т газа для характерных точек цикла и его термический КПД h.
Переход газа на участке 1-2 происходит изохорически при V 1 = const. Давления и температуры газов в состояниях 1 и 2 связаны между собой соотношением:
Отсюда T 2 = 2 Т 1 = 600 K. Так как переход газа 2-3 изотермический, то Т 2 = Т 3. Термический КПД цикла определяется выражением
где Q 1 – количество теплоты, полученное от нагревателя за цикл, Q 2 – количество теплоты, отданное холодильнику за цикл. Газ получает количество теплоты на участках 1-2 и 2-3 Q 1= Q 1-2 + Q 2-3, где Q 1-2 = C v v (T 2 - T 1) – количество теплоты, полученное при изохорическом нагревании,
Газ отдает количество теплоты на участке 3-1 при изобарическом сжатии: Q 3-1 = Q 2 = Cр
Подставив значения Q 1 и Q 2, С v и С р
Ответ: T 2 = T 3 = 600 K, η = 9,9 %.
Задача16. Кислород массой 1 кг совершает цикл Карно. При изотермическом расширении газа его объём увеличивается в 2 раза, а при последующем адиабатическом расширении совершается работа 3000 Дж. Определить работу, совершенную за цикл.
На рисунке 3 участок 1-2 соответствует изотермическому расширению газа (Т 1 = Т 2), участок 2-3 – адиабатическому расширению газа, участок 3-4 – изотермическому сжатию (Т 3 = Т 4) и участок 4-1 – адиабатическому сжатию. При изотермическом расширении внутренняя энергия идеального газа остается постоянной, следовательно, все подводимое тепло Q 1 идет на работу по расширению газа на участке 1-2, т.е.
 (1) (1)
При изотермическом сжатии на участке 3-4 Q 2 тепло отдается холодильнику (Q 2), и это количество теплоты определяется работой, затраченной на сжатие газа:
Состояния 2 и 3 лежат на одной адиабате, поэтому можно записать:
Для состояний 4 и 1, которые отвечают одной адиабате, имеем:
Поделив выражение (3) на (4), получим:
так как Т 1 = Т 2и Т 3 = Т 4. Работа при адиабатическом расширении на участке 2-3 равна:
Работа при адиабатическом сжатии на участке 4-1 равна:
Так как Т 1 = Т 2, а Т 3 = Т 4, то А 2 - 3 = -А 4 - 1, т.е. полная работа по адиабатическому сжатию и расширению равна нулю. Следовательно, работа цикла: А = А 1 - 2 – А 3 - 4. Из уравнений (1), (2) и (5) получим: Из уравнения (6) выразим разность температур Т 2 – Т 3, равную Т 1 – Т 3, и подставим в уравнение (7): Ответ: 831,6 Дж.
Задача 17. В результате изотермического расширения объем 8 г кислорода увеличился в 2 раза. Определить изменение энтропии газа.
сообщенное газу, Т – абсолютная температура, S 1 и S 2 – значения энтропии в начальном и конечном состояниях системы. При изотермическом расширении все подводимое количество теплоты идет на работу по расширению, т.е. dQ = dA = pdV. Из уравнения Менделеева – Клапейрона:
Подставляя выражение (2) в (1), получим:
Произведем вычисления:
Ответ: 1,44 Дж/град. Задача 18. Горячая вода некоторой массы отдает теплоту холодной воде такой же массы, и температуры их становятся одинаковыми. Показать, что энтропия при этом увеличивается.
Решение: Пусть температура горячей воды T 1, холодной – T 2, а температура смеси Θ. Определим температуру смеси, исходя из уравнения теплового баланса:
откуда: Изменение энтропии, происходящее при охлаждении горячей воды:
Изменение энтропии, происходящее при нагревании холодной воды:
Изменение энтропии системы равно
или с учетом соотношения (1) имеем: Так как Поэтому Ответ: энтропия увеличивается.
Задача 19. Лед массой 2 кг, находящийся при температуре –10°С, нагрели и превратили в пар. Определить изменение энтропии.
1. Изменение энтропии 2. Изменение энтропии 3. Изменение энтропии
где с 2 – удельная теплоемкость воды. 4. Изменение энтропии
где r – удельная теплота парообразования. Общее изменение энтропии
Задача 20. Резиновый шнур, жесткость которого k = 3 ·
k = 3·10
t = 27°C Так как при изотермическом процессе
А =
Отсюда: Ответ:
Задача 21. Углекислый газ массой 88 г находится в сосуде емкостью 10 л. Определить внутреннее давление газа и собственный объем молекул.
Постоянная Ван-дер-Ваальса b учитывает поправку на собственный объем молекул V’, и, как следует из уравнения Ван-дер-Ваальса, произведение
Ответ: 0,021 л. Список литературы
1. Савельев И.В. Курс общей физики. Кн.1. – М.: Наука, 1999. 2. Трофимова Т.И. Курс физики. – М.: Высшая школа, 2003. 3. Детлаф А.А., Яворский Б.М. Курс физики. – М.: Высшая школа, 2002. 4. Волькенштейн В.С. Сборник задач по общему курсу физики. – СПб.: СпецЛит, 2001. 5. Чертов А. Г., Воробьев А.А. Задачник по физике. – М.: Интеграл–пресс, 1997.
Составители: ШАТОХИН Сергей Алексеевич, Сагитова Эмма Вагизовна
|

 устанавливаем число киломолей ν;, содержащихся в заданном объеме V. Зная р - давление, V – объем, Т – температуру газа, R – молярную газовую постоянную
устанавливаем число киломолей ν;, содержащихся в заданном объеме V. Зная р - давление, V – объем, Т – температуру газа, R – молярную газовую постоянную

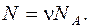
 .
.
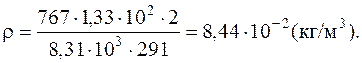
 (1)
(1)
 (2)
где р 1 – парциальное давление гелия; m 1 – масса гелия;
(2)
где р 1 – парциальное давление гелия; m 1 – масса гелия;
 (3)
(3) (4)
(4)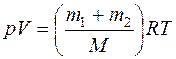 (5)
(5) , (6)
, (6) ;
; 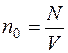 ;
;  ;
; Так как
Так как 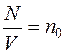 , имеем
, имеем  .
. , находим
, находим  Таким образом:
Таким образом: , (1)
, (1) , (2)
, (2)


 (1);
(1);  (2),
(2), (3)
(3) (4)
(4)  , (5)
, (5) (6)
(6)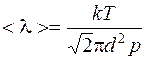 . (7)
. (7) . (8)
. (8) . С учетом (6) имеем:
. С учетом (6) имеем: 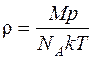 . (9)
. (9) .
.

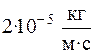 .
. (1)
где t – время протекания теплоты.
(1)
где t – время протекания теплоты.
 (2)
(2) ,
, ,
, 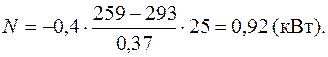
 Поступательному движению приписывается три (i = 3), а вращательному две (i= 2) степени свободы. Тогда энергия одной молекулы:
Поступательному движению приписывается три (i = 3), а вращательному две (i= 2) степени свободы. Тогда энергия одной молекулы: ,
,  .
. , где ν – число молей, NA – число Авогадро. Тогда средняя кинетическая энергия поступательного движения молекул водорода будет:
, где ν – число молей, NA – число Авогадро. Тогда средняя кинетическая энергия поступательного движения молекул водорода будет:  , (1)
, (1) . (2)
. (2)
 Дано:
Р 1 =100 кПа=1·105 Па
Р 2 = 1 МПа =1·106 Па
V 2 = const
g = 1,4
Р 3 –?
Дано:
Р 1 =100 кПа=1·105 Па
Р 2 = 1 МПа =1·106 Па
V 2 = const
g = 1,4
Р 3 –?


 (1)
(1) ,
, .
.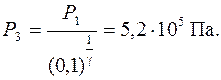
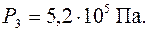
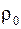
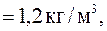 а давление Р 0 = 1,013 ∙ 105 Па. Температуру воздуха считать одинаковой.
а давление Р 0 = 1,013 ∙ 105 Па. Температуру воздуха считать одинаковой.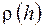 . Массу воздуха в элементе объема dV представим в виде:
dm =
. Массу воздуха в элементе объема dV представим в виде:
dm =  .
Найдем изменение плотности воздуха с высотой.
.
Найдем изменение плотности воздуха с высотой.

 . (1)
. (1) (2)
(2) (3)
(3)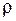 – плотность воздуха на высоте h.
– плотность воздуха на высоте h.


 ,
,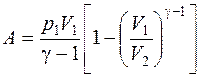 , где γ – отношение теплоемкостей газа при постоянном давлении и постоянном объеме (для кислорода γ =1,4).
, где γ – отношение теплоемкостей газа при постоянном давлении и постоянном объеме (для кислорода γ =1,4).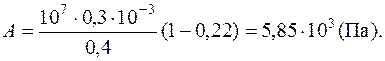 Так как
Так как  ,
, 
 , (1)
, (1)
 , (2)
, (2) , где М = 32·1023 кг/моль – молярная масса кислорода; NA =
, где М = 32·1023 кг/моль – молярная масса кислорода; NA =  – постоянная Авогадро.
– постоянная Авогадро. , масса которых:
, масса которых:  . (3)
. (3) . (4)
. (4)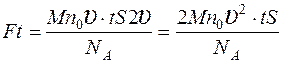 , откуда
, откуда  ,
,  .
.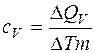 , где
, где  , т.е. все сообщаемое количество теплоты идет на изменение внутренней энергии системы. Изменение внутренней энергии смеси газа определяется формулой:
, т.е. все сообщаемое количество теплоты идет на изменение внутренней энергии системы. Изменение внутренней энергии смеси газа определяется формулой:  , где i 1 и i 2 – число степеней свободы первого и второго газов.
, где i 1 и i 2 – число степеней свободы первого и второго газов. . (1)
. (1) , (2)
, (2)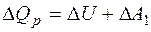 , т.е. сообщаемое газу количество теплоты идет не только на изменение внутренней энергии, но и на работу по расширению газа. Работа при изобарическом расширении для каждого газа равна:
, т.е. сообщаемое газу количество теплоты идет не только на изменение внутренней энергии, но и на работу по расширению газа. Работа при изобарическом расширении для каждого газа равна:  ;
;  , поэтому:
, поэтому: .
. .
.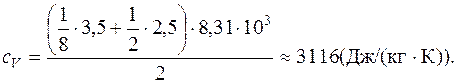
 .
. i = 5
i = 5
 , где
, где  – отношение теплоемкостей газа при
– отношение теплоемкостей газа при
 .
. .
.

 , (1)
где i – число степеней свободы молекул газа для двухатомных молекул кислорода (i = 5); М – молярная масса; R – молярная газовая постоянная.
, (1)
где i – число степеней свободы молекул газа для двухатомных молекул кислорода (i = 5); М – молярная масса; R – молярная газовая постоянная.
 . (2)
. (2) (3)
(3)


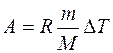 . Подставив числовые значения, получим:
. Подставив числовые значения, получим:
 . Согласно первому началу термодинамики количество теплоты Q, переданное газу, равно сумме изменения внутренней энергии Δ U и работы А:
. Согласно первому началу термодинамики количество теплоты Q, переданное газу, равно сумме изменения внутренней энергии Δ U и работы А: 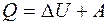 , следовательно:
, следовательно:  .
.
 Р 1= 0,1 Мпа = 1·105 Па
Т 1= 300 К
Р 2= 0,2 Мпа = 2·105 Па
Р 1= 0,1 Мпа = 1·105 Па
Т 1= 300 К
Р 2= 0,2 Мпа = 2·105 Па
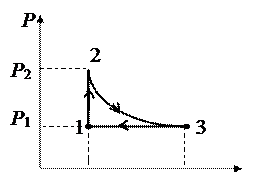 В координатах Р, V график цикла имеет следующий вид
В координатах Р, V график цикла имеет следующий вид

 =
= 
 .
.  , (1)
, (1) – количество теплоты, полученное при изотермическом расширении.
– количество теплоты, полученное при изотермическом расширении.
 – молярная теплоемкость газа при V = const, C р
– молярная теплоемкость газа при V = const, C р  – молярная теплоемкость газа при P = const.
– молярная теплоемкость газа при P = const.  ,
, 

 (2)
(2) (3)
(3) (4)
(4)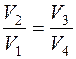 , (5)
, (5) (6)
(6)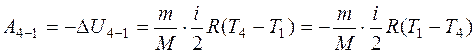 .
. (7)
(7) . Произведем вычисления:
. Произведем вычисления:  .
. M = 32 кг/кмоль
V 2 = 2 V 1
M = 32 кг/кмоль
V 2 = 2 V 1
 (1)
где dQ – количества тепла,
(1)
где dQ – количества тепла,
 поэтому:
поэтому: (2)
(2)

 , или
, или 
 . (1)
. (1)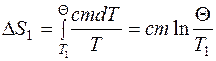 .
. .
. ,
, .
. , то
, то  и
и  .
. , т.е. энтропия возросла.
, т.е. энтропия возросла.
 .
Общее изменение энтропии равно сумме
.
Общее изменение энтропии равно сумме  , где
, где 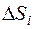 – изменения энтропии, происходящие на отдельных этапах процесса:
– изменения энтропии, происходящие на отдельных этапах процесса:
 .
.
 происходит при нагревании льда от начальной температуры T 1 = 263 K до температуры плавления T 2 = 273 K:
происходит при нагревании льда от начальной температуры T 1 = 263 K до температуры плавления T 2 = 273 K:  , так как
, так как  , то
, то  , где m – масса льда; с 1 – удельная теплоемкость льда.
, где m – масса льда; с 1 – удельная теплоемкость льда. происходит при плавлении льда. В этом случае
происходит при плавлении льда. В этом случае  . Тогда:
. Тогда: 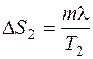 , где T 2– температура плавления льда; λ – удельная теплота плавления.
, где T 2– температура плавления льда; λ – удельная теплота плавления. происходит при нагревании воды от температуры T 2 до температуры кипения T 3 = 373 K. Величина
происходит при нагревании воды от температуры T 2 до температуры кипения T 3 = 373 K. Величина  ,
, происходит при испарении воды; так как
происходит при испарении воды; так как  , то
, то ,
,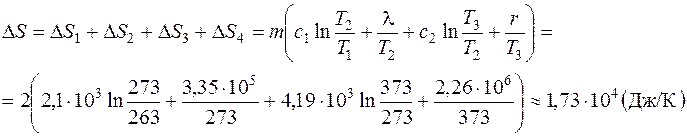 Ответ: 1,73·104 Дж/К.
Ответ: 1,73·104 Дж/К. H/м под действием груза удлинился на
H/м под действием груза удлинился на 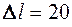 см. Считая процесс растяжения шнура изотермическим и происходящим при температуре t = 27°C, определить изменение энтропии.
см. Считая процесс растяжения шнура изотермическим и происходящим при температуре t = 27°C, определить изменение энтропии. Дано: Решение:
Дано: Решение: Согласно 1-го закона термодинамики
Согласно 1-го закона термодинамики

 то
то 
 Процесс растяжения шнура происходит при постоянной температуре, а значит изменения внутренней энергии не происходит. Работа А равна изменению потенциальной энергии резинового шнура:
Процесс растяжения шнура происходит при постоянной температуре, а значит изменения внутренней энергии не происходит. Работа А равна изменению потенциальной энергии резинового шнура: ,
,

 ,
где а –постоянная Ван-дер-Ваальса, V – объем.
,
где а –постоянная Ван-дер-Ваальса, V – объем.

 равно учетверенному объему молекул
равно учетверенному объему молекул 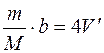 , откуда:
, откуда: .
.


