Способы и методы окислительно-восстановительного титрования
Способы и методы окислительно-восстановительного титрования Окислительно-восстановительное титрование основано на реакциях окисления-восстановления. Если титрант – окислитель, то титрование называют окислительным. Если титрант – восстановитель, то титрование восстановительное. По типу применяемого титранта методы окислительно-восстановительного титрования делятся на следующие виды: • Пермангатометрическое – титрант раствор KMnO4; • Иодометричес кое титрование – титранты растворы I2 и Na2S2O3; • Броматометрическое – титрант раствор КВrО3; • Бромометрическое – титрант раствор Вr2 (КВrО3 + КВr) • Хроматометрическое – титрант раствор К2Сr2О7 и т.д. Перманганатометрия используется для определения множества веществ -восстановителей и кислителей (с предварительным восстановлением): а) один из лучших способов определения железа в разных объектах; б) с предварительным восстановлением можно определять: V, Mo, W, Ti, Sn, Sb, U, которые после растворения образцов получаются в высшей степени окисления; в) используется для определения нитритов обратным титрованием. Прямое титрование невозможно, поскольку нитрит в кислой среде неустойчив; поэтому добавляют избыток перманганата и через некоторое время оттитровывают избыток стандартным раствором соли Мора. г) для определения ионов, образующих малорастворимые оксалаты(Ca, Mg, Zn, Ba, Pb, Ag, Sr, Co), которые отделяют от раствора, растворяют в кислоте и затем оттитровывают щавелевую кислоту; ж) для определения общей окисляемости воды или почвы. Дихроматометрия. Достоинством метода является то, что раствор К2 Сr2 О7 очень устойчив и удовлетворяет требованиям первичного стандарта. Его применяют для определения железа (после предварительного восстановления) и органических компонентов воды или почвы. Индикатором служат Rеdох – индикаторы – дифениламин и его производные. Броматометрия. Достоинством метода является устойчивость и чистота бромата калия. Является лучшим методом для определения сурьмы (Sb) и олова (Sn). Также применяют для определения мышьяка, железа и органических соединений.
Йодиметрия. Реакция окисления-восстановления с участием йода обратима: J2 + 2 e ↔ 2J– Е Йод плохо растворим в воде, но в присутствии иодид-ионов образуется комплекс I3-, поэтому при титровании протекает реакция
Стандартные потенциалы многих восстановителей меньше Е=0,54В, а многих окислителей выше, поэтому система служит для определения как восстановителей так и окислителей. При определении восстановителей прямым титрованием рабочим раствором служит раствор йода, который готовят растворением смеси I2 с КI в очищенной от ионов металлов воде. Хранят раствор в темной склянке во избежание окисления йодида и улетучивания образовавшегося йода. Использовать раствор иодида для определения окислителей путем прямого титрования невозможно, т.к. прямая реакция восстановления йода идет быстро, а обратная реакция окисления йодида протекает медленнее. Поэтому используют заместительное титрование. К окислителю добавляют избыток иодида, а выделившийся йод оттитровывают стандартным раствором Nа2S2О3 (тиосульфат натрия). Индикатором является крахмал. Этот метод используют для определения очень многих окислителей. Кроме этого йодиметрия это лучшей и самый точный метод определения сравнительно больших количеств меди. Титрование проводят при рН
Редокс-титрование может быть выполнено различными способами: прямое титрование, обратное титрование и заместительное титрование. Прямое титрование проводят при ЭДС ≥ 0,4 В, что обеспечивает необходимую полноту и скорость протекания реакции. Прямым титрованием можно определить: а) ионы Fe2+ – титрант раствор KMnO4 (ЭДС = 0,74 В; К = 106,4) 10 FeSO4 + 2 KMnO4 + 8 Н2SO4 = 5 Fe2(SO4)3 + 2 MnSO4 + К2SO4 + 8 Н2О ν(1/z* FeSO4) = ν(1/z* KMnO4) б) I+ – титрант раствор Na2S2O3 (ЭДС = 0,42 В, К = 108) I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6 ν(1/z* I2) = ν(1/z* Na2S2O3) Обратное титрование – используют при медленно протекающих реакциях. При этом к титруемой смеси добавляют избыток титранта 1 и выдерживают определенное время (для полноты протекания реакции). Затем избыток титранта 1 оттитровывают другим титрантом 2. а) при определении сульфидов добавляют избыток раствора I2 (титрант 1), избыток которого затем оттитровывают раствором Na2S2O3 (титрант 2). Na2S + I2 (избыток) 2 НС1 = S + 2 NaС1 + 2 НI I2 (остаток) + 2 Na2S2O3 = 2 NaI + Na2S4O6 ν(1/z* Na2S) = ν(1/z* I2) = ν(1/z* Na2S2O3); ν(1/z* Na2S) = ν(1/z* Na2S2O3); б) определение содержания свободного или связанного формальдегида в разнообразных технических продуктах. НСНО + Н2О2 = НСООН + Н2О НСНООН + NaОН(избыток) = НСООNa + Н2О NaОН(остаток) + НС1 = NaС1 + Н2О ν(1/z* НСНО) = ν(1/z* NaОН) = ν(1/z* НС1); ν(1/z* НСНО) = ν(1/z* НС1); Заместительное титрование – определяют заместитель – продукт реакции, выделяющийся в эквивалентном количестве при взаимодействии определяемого вещества с каким-либо реактивом. Таким образом, например, можно определять вещества, не вступающие в окислительно-восстановительные реакции. а) определение карбоната кальция: СаСО3 + 2 НС1 = СаС12 + Н2СО3 СаС12 + (NН4)2С2О4 = СаС2О4 + 2 NН4С1 СаС2О4 + Н2SO4 = СаSO4 + Н2С2О4 5 Н2С2О4 + 2 KMnO4 + 2 Н2SO4 = 2 MnSO4 + 10 СО2 + 8 Н2О ν(1/z* СаСО3) = ν(1/z* KMnO4) б) определение диоксида марганца в пиролюзите: MnO2 + 4 НС1(к) = MnС12 + С12 + 2 Н2О С12 + КI = I2 + 2 КС1 I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6 ν(1/z* MnO2) = ν(1/z* Na2S2O3)
|

 = 0,62 В.
= 0,62 В.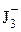 + 2е ↔3 J– Е
+ 2е ↔3 J– Е  = 0,54 В.
= 0,54 В. 2÷4.
2÷4.


