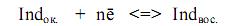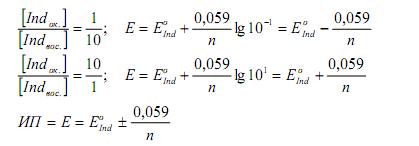Окислительно-восстановительные индикаторы
Для определения точки эквивалентности используют различные индикаторы: 1) Окислительно-восстановительные индикаторы (редокс-индикаторы), изменяющие цвет при изменении октслительно-восстановительного потенциала системы. 2) Специфические индикаторы, изменяющие свой цвет при появлении избытка титранта или исчезновении определяемого вещества. Специфические индикаторы – применяют в некоторых случаях. Крахмал – индикатор на присутствие свободного йода, вернее трииодидионов I3-. В присутствии I3- крахмал при комнатной температуре синеет. Появление синей окраски крахмала связано с адсорбцией I3- на амилазе, входящей в состав крахмала. Характер цвета зависит от длины и разветвленности основной полисахаридной цепи. Амилопектин крахмала имеет разветвленную цепь и дает пурпурно-красную окраску, декстрин и гликоген – красно-коричневую. При стоянии раствора крахмала происходит гидролиз, полисахаридные цепи укорачиваются, и окраска из синей, превращается в красную. Иногда в качестве индикатора используют тиоцианат аммония - при титровании солей железа(III). В точке эквивалентности титруемый раствор из красного становится бесцветным. При титровании раствором перманганата калия сам титрант играет роль индикатора. При малейшем избытке KMnO4 раствор окрашивается в розовый цвет. Редокс-индикаторы делятся на: обратимые и необратимые. Обратимые индикаторы – обратимо изменяют свой цвет при изменении потенциала системы. Необратимые индикаторы – подвергаются необратимому окислению или восстановлению, в результате чего цвет индикатора изменяется необратимо. Редокс-индикаторы существуют в двух формах окисленной (Ind ок.) и восстановленной (Ind вос.), причем цвет одной формы отличается от другой.
Переход индикатора из одной формы в другую и изменение его окраски происходит при определенном потенциале системы (потенциале перехода). Потенциал индикатора определяется по уравнению Нернста:
При равенстве концентраций окисленной и восстановленной форм индикатора Е = Ео. При этом половина молекул индикатора существует в окисленной форме, половина – в восстановленной форме. Интервал перехода индикатора (ИП) лежит в пределах отношений концентраций обеих форм индикатора от 1/10 до 10/1 и равен:
При проведении окислительно-восстановительного титрования необходимо подбирать индикатор таким образом, чтобы потенциал индикатора находился в пределах скачка потенциала на кривой титрования. Многие индикаторы окислительно-восстановительного титрования обладают кислотными или основными свойствами и могут менять свое поведение в зависимости от рН среды. Титрование индикаторным методом возможно, если для данной реакции ЭДС ≥ 0,4 В. При ЭДС = 0,4 – 0,2 В используют инструментальные индикаторы.
|