СТАНДАРТИЗАЦИЯ РАСТВОРА ПЕРМАНГАНАТА КАЛИЯ ПО ОКСАЛАТУ НАТРИЯ
Ход анализа. Бюретку заполняют раствором КМnО4 (доводя раствором титранта до нуля по верхнему мениску). В колбу для титрования пипеткой вносят аликвотные части раствора оксалата натрия Na2C2O4 (10, 20 мл), подкисляют 10-20 мл 2н. раствора серной кислоты (кислоту отмеряют цилиндром), нагревают эту смесь до 70-80°С (без кипячения раствора). Нагретый раствор титруют перманганатом до бледно-розовой окраски, не исчезающей в течение 30 сек. Вначале обесцвечивание идет очень медленно, по мере накопления ионов Мn2+ реакция идет быстрее. Измерение объема окрашенного титранта ведут по верхнему мениску. Титрование повторяют несколько раз, до получения воспроизводимых результатов, отличающиеся не более чем на 0,1 мл. Записывают все полученные объемы, берут среднее из воспроизводимых результатов. Рассчитывают молярную концентрацию эквивалента: Расчет С(1/5КМnО4)= (СH·V)Na2C2O4 / V(КМnО4)
ЛАБОРАТОРНАЯ РАБОТА ОПРЕДЕЛЕНИЕ ПЕРЕКИСИ ВОДОРОДА В ЛЕКАРСТВЕННОЙ ФОРМЕ 5H2O2 + 2MnO4- + 6H+ ® 2Mn2+ + 5O2 + 8H2O
MnO4- + 8H+ +5ē ® Mn2+ + 4H2O
H2O2 - 2ē ® 2H+ + 5O2
Ход анализа. В колбу для титрования пипеткой вносят аликвотную часть 10 мл (предварительно разбавленного в 20 раз) раствора перекиси водорода лекарственной формы, подкисляют 10 мл 2н раствора серной кислоты (кислоту отмеряют цилиндром) и содержимое колбы титруют (без нагревания) рабочим раствором перманганата калия до появления неисчезающего, розового окрашивания. Титрование повторяют еще 1-2 раза. Расчет m(Н2О2) = ω(Н2О2) = СН (KMnO4) – нормальность раствора перманганата; V (KMnO4) - объем перманганата калия, пошедшего на титрование, мл; VK-объем мерной колбы; Va- аликвотная часть перекиси водорода, мл; Мэ (Н2О2) – молярная масса эквивалента перекиси водорода; V(Н2О2)- исходный объем перекиси водорода лекарственной формы, взятый для разбавления; ρ(Н2О2)- плотность раствора перекиси водорода (можно принять равной 1гр/мл).
|

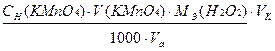 ,
,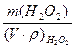 , где
, где


