Диаграмма состояния воды
Во все века свадьба считалась чистым и нежным ритуалом. Поэтому подарок в этот день должен быть соответствующим. Диаграмма состояния воды – это графическое отображение равновесного состояния фаз воды, строится в зависимости от температуры и давления. Кривые парообразования, кристаллизации. Состояния равновесия. ОА= кривая сублимации, возгонки (тв-пар); ВВ’О – кривая плавления. АО- кривая сублимации, ОК-кривая парообразования, процесс регулируется дефицитом влажности. Замечательные точки: О – тройная точка, равновероятное сущ-е всех 3 состояний (610 Па, темп 0,01 С0. К – критическая темп-ра (2,2*107Па, 374С). При превышении К больше невозможно существование жидкой воды. Некоторая субстанция – пар/лед.
6 и 7– горячие формы льда. 9 – метастабильная. при переохлаждении 2 льда.
Структура воды в разных агрегатных состояниях воды различна. Гипотеза, объясняющая, почему вода плотнее льда: в твердом состоянии – гексагональная сингония, т.е. в вершине 6 атомов кислорода, между ними атомы водорода. Когда лед тает, часть водородных связей разрушается, и отдельные молекулы освобождаются и могут занимать «дырки», т.е. идет уплотнение, а объем уменьшается. При дальнейшем увеличении температуры растет кинетическая энергия, а плотность уменьшается. При 20° примерно половина молекул остается в ассоциации. Только при 100° разрушается ассоциация, каждая молекула освобождается и становится паром. Фазовые переходы: изменение агрегатного состояния вещества происходит скачкообразно + выделяется/поглощается энергия, т.е. теплота фазового перехода. Точка кипения – при 1013 кПа 100С, замерзания 0С. На снижение темп-ры замерзание влияет соленость воды. Тзам. = -0,054S, где S – соленость, ‰. График Хелланд-Хансена (точка T=-1,33С; S=24,7‰).
|

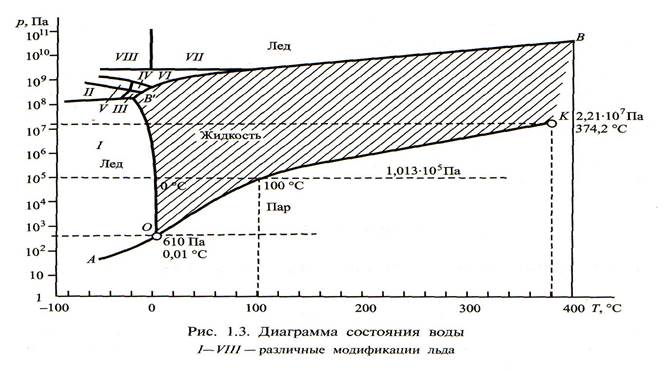 В верхнем левом углу полиморфные формы льда. Известно 14 модификаций льда. Почти все получены искусственным образом при очень высоком давлении и очень низких температурах. Полиморфизм льда проявляется в деформации водородных связей, структуры решетки льда, температуре образования и т.д.
В верхнем левом углу полиморфные формы льда. Известно 14 модификаций льда. Почти все получены искусственным образом при очень высоком давлении и очень низких температурах. Полиморфизм льда проявляется в деформации водородных связей, структуры решетки льда, температуре образования и т.д. 13 и 14 модификации открыты в 2006 году. Моноклинная ромбическая структура. Оч. маленькое давление, - 160 град.
13 и 14 модификации открыты в 2006 году. Моноклинная ромбическая структура. Оч. маленькое давление, - 160 град.


