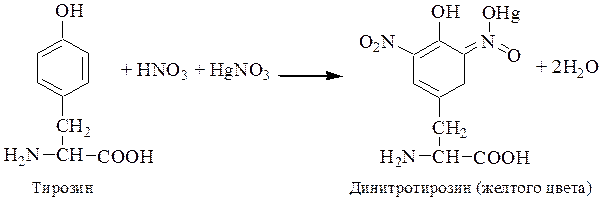Лабораторные работы
Лабораторная работа № 1. Цветные реакции на белки и аминокислоты Биуретовая реакция. Принцип метода. См. в занятии «Строение и функции белков». ВНИМАНИЕ! Соблюдать меры безопасности при работе с гидроксидом натрия. Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 5 капель 10 %-го раствора гидроксида натрия и по 1 капле 1 %-го раствора медного купороса. Во всех пробирках наблюдают устойчивое сине-фиолетовое окрашивание. Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Нингидриновая реакция. Принцип метода. Основан на образовании димера нингидрина и азота аминогруппы сине-фиолетового цвета (комплекс Руэмана ‑ см. уравнение).
Ход работы. К 5 каплям раствора белка прибавить 5 капель раствора нингидрина и прокипятить 1–2 мин. Появляется сине-фиолетовое окрашивание.
Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Ксантопротеиновая реакция (Мульдера). Принцип метода. Основан на образовании нитросоединений ароматических и гетероциклических аминокислот, окрашенных в ярко-желтый цвет (см. уравнение).
ВНИМАНИЕ! Соблюдать меры безопасности при работе с концентрированной азотной кислотой.
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 3 капли концентрированной азотной кислоты и осторожно кипятят. В первой пробирке образуется осадок желтого цвета, а во второй – слабое окрашивание, т. к. желатин не содержит циклических аминокислот. В 3‑й пробирке образуется осадок белого цвета, переходящий в желтый цвет. Пробирки охлаждают и добавляют в каждую по 10–15 капель 20 %-го едкого натра до изменения окраски растворов вследствие образования натриевой соли динитротирозина. Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Реакция на тирозин (Миллона). Принцип метода. Основан на образовании осадка ртутной соли динитротирозина кроваво-красного цвета (см. уравнение).
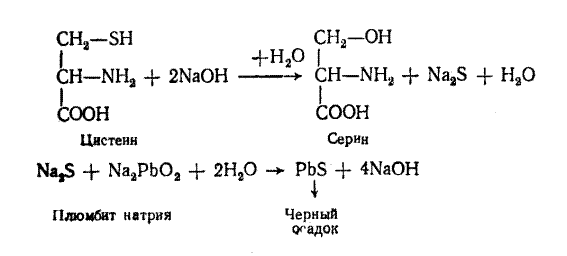
ВНИМАНИЕ! Соблюдать меры безопасности при работе с реактивом Миллона (содержит Hg и HNO3). Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 3 капли реактива Миллона (раствор ртути в азотной кислоте) и осторожно нагревают. Отмечают изменение цвета в пробирках, характеризующее наличие в указанных белках тирозина. Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Реакция Фоля (на аминокислоты, содержащие слабосвязанную серу). Принцип метода. Основан на щелочном гидролизе сульфгидрильных групп SH белка с последующим отщеплении серы в виде сульфида свинца (PbS) черно-бурого цвета (см. уравнение).
ВНИМАНИЕ! Соблюдать меры безопасности при работе с реактивом Фоля (содержит NaOH и Na2PbO2).
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 5 капель реактива Фоля. Затем интенсивно кипятят и дают постоять 1–2 мин. При этом в 1-й и в 3-й пробирках образуется черный или бурый осадок сульфида свинца. Желатин осадка не образует, т. к. в нем нет серосодержащих аминокислот. Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Лабораторная работа № 2. Реакции осаждения белков Осаждение белков при кипячении. ВНИМАНИЕ! Соблюдать меры безопасности при работе с нагреванием пробирок.
Ход работы. В 5 пробирок наливают по 5 капель раствора белка. Первую пробирку нагреть до кипения. Жидкость мутнеет, т. к. разрушаются водные оболочки вокруг молекулы белка, и происходит укрупнение его частиц. Мицеллы белка несут заряд и удерживаются во взвешенном состоянии. Во 2-й пробирке нагреть раствор до кипения и добавить 2 капли 1 %-го раствора уксусной кислоты до слабого подкисления. При отстаивании выпадает осадок белка. Частицы белка теряют заряд и приближаются к изоэлектрическому состоянию. В 3-ю пробирку добавить 5 капель уксусной кислоты для сильнокислой реакции среды. При кипячении жидкости осадка не образуется, поскольку белковые мицеллы перезаряжаются и несут положительный заряд, что повышает их устойчивость. В 4-ю пробирку налить 5 капель раствора уксусной кислоты, 2 капли насыщенного раствора хлористого натрия и нагреть. Выпадает белый хлопьевидный осадок, т. е. частицы белка теряют заряд. В 5-ю пробирку добавить 2 капли раствора гидроксида натрия. При кипячении осадок не образуется, т. к. в щелочной среде отрицательный заряд на частицах белка увеличивается. Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Осаждение белков концентрированными минеральными кислотами. ВНИМАНИЕ! Соблюдать меры безопасности при работе с концентрированными азотной и серной кислотами. Ход работы. В 2 пробирки наливают по 10 капель концентрированных кислот: азотной и серной. Наклонив пробирки под углом 45 градусов, осторожно по стенке пробирки приливают равный объем раствора белка так, чтобы обе жидкости не смешивались. На границе двух жидкостей образуется осадок в виде небольшого белого кольца. При добавлении избытка азотной кислоты осадок не исчезает, а при добавлении серной кислоты осадок растворяется. Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Осаждение белков органическими растворителями. Ход работы. В 2 пробирки вносят по 5 капель раствора белка и прибавляют по 15–20 капель этилового спирта и ацетона. Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Осаждение белков органическими кислотами. ВНИМАНИЕ! Соблюдать меры безопасности при работе с трихлоруксусной кислотой. Ход работы. В две пробирки наливают по 5 капель раствора белка и добавляют по 2 капли раствора ТХУ (трихлоруксусной кислоты) в одну и 2 капли сульфосалициловой – в другую. Следят за изменением растворов. Выводы по результатам работы.
______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Лабораторная работа № 3. Разделение альбуминов и глобулинов методом высаливания (УИРС) Принцип метода. Основан на обратимой реакции осаждения белков из растворов с помощью высоких концентраций нейтральных солей (NaCl, NH4Cl, MgSO4 и др.). Ход работы. К 1 мл неразведенного яичного белка добавляют 1 мл насыщенного раствора сульфата аммония и перемешивают. Получается полунасыщенный раствор сульфата аммония, в котором выпадает осадок яичного глобулина. Через 5 мин осадок отфильтровывают, в фильтрате остается яичный альбумин. Для высаливания альбуминов к фильтрату добавляют порошок сульфата аммония до полного насыщения, т. е. пока новая порция порошка остается нерастворенной. Выпавший осадок альбумина отфильтровывают. С фильтратом проделывают биуретовую реакцию. Отрицательная реакция указывает на отсутствие белка. Выводы по результатам работы. ______________________________________________________________ ______________________________________________________________ ______________________________________________________________ Рекомендуемая литература Основная 1 Кухта, В.К и др. Биологическая химия: учебник / В.К. Кухта, Т.С. Морозкина, Э.И. Олецкий, А.Д. Таганович; под ред. А.Д. Тагановича. – Минск: Асар, М.: Издательство БИНОМ, 2008. – С. 45-46, 54-60. 2 Биохимия: Учебник для вузов / Под ред. Е.С. Северина. – 4-е изд., испр. – М.: ГЭОТАР-Медиа, 2006. – С. 9-73, 75-80, 83-92. 3 Филиппович, Ю. Б. Основы биохимии. – 4-е изд. – М.: Агар, 1999. – С. 49-78, 95-105. 4 Николаев, А.Я. Биологическая химия. М.: Медицинское информационное агентство, 2004. – С. 61-63, 68-78. 5 Марри Р. и др. Биохимия человека: в 2-х т.: Пер. с англ., М.: Мир, 2004. – Т.1: С. 47-51, 63-66, 79-81. Дополнительная 6 Березов, Т. Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – С. 114-143. 7 Ленинджер, А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 226–302. 8 Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия, М.: Медицина, 1991. С. 313–376. 9 Албертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994. Т. 1. С. 113–171.
Занятие 4 Дата: _________________
Ферменты-2. Механизм действия ферментов Цель занятия: закрепить знания по структуре ферментов, сформировать представления о механизме действия ферментов. Научиться выполнять качественные реакции на активность некоторых гидролитических ферментов.
|