Коллоидно-дисперсные системы
9.1. Общие положения Системы, в которых одна составная часть распределена в мелкораздробленном состоянии в среде другой, называются дисперсными. Составная часть, распределённая в виде отдельных мелких твёрдых частиц, капелек жидкости или пузырьков газа, составляет дисперсную фазу, а другая часть, окружающая частицы дисперсной фазы, называется дисперсионной средой. Дымы и туманы в воздухе, взвеси глины и песка в воде, коллоидные системы, содержащие частицы, более крупные, чем обычные молекулы, и, наконец, истинные растворы - молекулярные или ионные – всё это различные дисперсные системы. В зависимости от размера частиц дисперсной фазы системы делятся на а) грубодисперсные (взвеси) - диаметр частиц больше 10 –5 см; б) коллоидно-дисперсные (золи) – 10–5 – 10 –7 см; в) истинные растворы – размер частиц меньше 10–7 см. Взвеси могут существовать в виде суспензий или эмульсий. В первом случае твёрдое вещество взвешено в жидкости (мел в воде), во втором – жидкое вещество в жидкости (жир в воде). Частицы грубодисперсных систем различимы визуально и, если они распределены в жидкости или газе, то постепенно оседают или всплывают. В коллоидных системах дисперсная фаза нерастворима в дисперсионной среде и отделена от неё поверхностью раздела; таким образом, коллоидные системы являются гетерогенными системами в отличие от истинных растворов, которые являются гомогенными, однородными. Если дисперсионная среда – жидкость, а дисперсная фаза – твёрдое вещество, коллоидная система называется золем; если дисперсная фаза – жидкость, система называется эмульсией. Высокоразвитая поверхность раздела между дисперсной фазой и дисперсионной средой в коллоидных системах создаёт большой избыток поверхностной энергии. Поэтому с увеличением дисперсности (или удельной поверхности) коллоидные системы становятся менее устойчивыми. Они всегда стремятся к самопроизвольному уменьшению межфазной поверхности, т.е. к снижению дисперсности: частицы укрупняются, образуя более крупные агрегаты. Свойство коллоидных систем увеличивать размер частиц путём их агрегации называется агрегативной неустойчивостью. Для получения устойчивой коллоидной системы необходимо присутствие в системе стабилизатора. В большинстве случаев стабилизатором является электролит, находящийся в растворе. Один из ионов электролита адсорбируется на поверхности коллоидных частиц, сообщая им одноимённый заряд, препятствующий их агрегатированию (слипанию). Ионы противоположного знака находятся в дисперсионной среде. 9.2. Получение коллоидных систем Благодаря тому, что коллоидные системы занимают промежуточное положение между грубодисперсными и молекулярно-дисперсными системами, их можно получить принципиально различными методами. а) дисперсионные методы: дробление более крупных по размеру частиц до коллоидной степени дисперсности механическим измельчением частиц, электрическим диспергированием и ультразвуковым методом; б) конденсационные методы: укрупнение частиц путём соединения (конденсации) атомов и молекул в агрегаты с коллоидно-дисперсной степенью дисперсности; к этой группе методов относят получение золей конденсацией паров, заменой растворителя и с помощью различных химических реакций (метод химической конденсации). Основные условия, необходимые для получения и длительного хранения коллоидных систем, независимо от способов их получения, следующие: 1) нерастворимость частиц дисперсной фазы в дисперсионной среде; 2) достижение коллоидной степени дисперсности (10--5 – 10 --7 см) частицами дисперсной фазы; 3) наличие в системе третьего компонента - стабилизатора, который сообщает системе агрегативную устойчивость. 9.3. Строение мицелл золей В настоящее время общепринятой теорией строения коллоидных частиц является мицеллярная теория, согласно которой мицелла - это агрегат молекул и ионов, состоящий из ядра и двойного электрического слоя. А двойной электрический слой состоит из адсорбционного слоя родственных ионов и противоионов и диффузного слоя противоионов. Мицелла электронейтральна, т.к. в ней число положительных ионов равно числу отрицательных. В электрическом поле коллоидные частицы перемещаются с постоянной скоростью к одному из электродов, т.к. обладают одноимённым зарядом (либо положительным, либо отрицательным). Наличие одноимённого заряда у всех частиц данного золя является важным фактором его устойчивости. Заряд препятствует слипанию, укрупнению и выпадению в осадок коллоидного вещества. Чаще всего причиной возникновения заряда является процесс адсорбции ионов того или иного знака поверхностью частиц. По правилу Пескова-Фаянса: на любой твёрдой поверхности будут адсорбироваться те ионы, которые имеют с этой поверхностью общую родственную атомную группировку и находятся в растворе в избытке. Пример 1. Примером получения золя методом двойного обмена может служить реакция 2H3AsO3 + 3H2S à As2S3 + 6H2O, в случае, если одно из веществ взято в избытке (оно будет выполнять роль стабилизатора), а другое – в недостатке (что предотвращает рост зародышей коллоидных частиц до крупных размеров). При избытке, например, H2S, идёт реакция
2H3AsO3 + 3H2S à As2S3 + 6H2O изб ядро В данных условиях молекулы As2S3, конденсируясь, образуют ядро мицеллы m[As2S3]. Известно, что вещество, которое берётся в избытке, является стабилизатором. В данном случаe им будет H2S, которая диссоциирует по уравнению: H2S <=> H+ + HS– По правилу Пескова-Фаянса на ядре m[As2S3] будут адсорбироваться ионы nHS– (как родственные и находящиеся в растворе в избытке). Эти ионы плотно прилегают к ядру и называются потенциалопределяющими. Они определяют направление движения коллоидной частицы при электролизе. Далее отрицательно заряженные ионы HS– притягивают из раствора часть находящихся в избытке ионов Н+, образующих адсорбционный слой противоионов (n-x)H+. Ядро m[As2S3], адсорбционный слой ионов nHS– и противоионов (n-х)Н+ образуют гранулу, несущую отрицательный заряд, т.к. ионов nHS- больше, чем (n-х)H+ на число х. Другая часть противоионов хН+ образуют диффузную часть двойного электрического слоя, окружающего ядро мицеллы. Схема строения мицеллы золя сульфида мышьяка:
{[mAs2S3] * nHS– * (n-x)H+ }x – * xH+ | < ядро >| <адсорбционный >| < диффузный | | | слой | слой | |< ---------- гранула -----------> | | | < -------------- мицелла ----------------------- > |
В электрическом поле гранула, имеющая отрицательный заряд, перемещается к аноду, а противоионы – к катоду. 9.4. Явление коагуляции Коагуляция - процесс слипания частиц с образованием более крупных агрегатов. Внешне коагуляция проявляется в помутнении золя, в изменении окраски золя, в выпадении твёрдой фазы в осадок или в образовании студнеобразной массы. Коагуляция происходит вследствие уменьшения электрокинетического (или Коагуляцию коллоидных растворов можно вызвать нагреванием, замораживанием, интенсивным перемешиванием, прибавлением к золю электролита. Наиболее изучена коагуляция при добавлении к золю электролитов. Коагуляция электролитами подчиняется правилам Шульце-Гарди, которые можно сформулировать следующим образом: 1) коагуляцию вызывает ион, заряженный противоположно грануле золя; 2) чем больше заряд коагулирующего иона, тем сильнее его коагулирующее действие. Минимальное количество электролита, прибавляемое к золю, которое может вызвать коагуляцию золя, называют порогом коагуляции С(пор) моль/л. Примеры решения задач Пример 2. Определение заряда коллоидных частиц. Золь иодида серебра AgJ получен при добавлении к 0,02 л 0,01н. раствора KJ 0,028 л 0,005 н. AgNO3. Определите заряд полученного золя и напишите формулу его мицеллы. Решение: При смешивании растворов AgNO3 и KJ протекает реакция: AgNO3 + KJ = AgJ + KNO3 Определяем количества AgNO3 и KJ, участвующих в реакции: а) n (AgNO3 )= 0,005 . 0,028 = 1,4 . 10-4 (моль); б) n (KJ) = 0,02 . 0,01 = 2,0 . 10-4 (моль). Расчёт показывает, что в растворе избыток KJ, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы J – и частицы золя приобретают отрицательный заряд. Противоионами являются ионы К+. Формула мицеллы золя иодида серебра при условии избытка KJ имеет вид: {m[AgJ]
Пример 3. Определение минимального объёма электролита, необходимого для получения золя. Какой объём 0,002 н. раствора BaCl2 надо прибавить к 0,03 л 0,0006 н.Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя BaSO4. Решение: Образование золя BaSO4 происходит по уравнению: BaCl2 + Al2(SO4)3 = 3BaSO4 + 2AlCl3 Если вещества участвуют в стехиометрических соотношениях, то для реакции необходимо:
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Следовательно, для реакции нужно взять более 0,009 л 0,002 н. раствора BaCl2. Формула мицеллы золя сульфата бария:
Пример 4. Вычисление порога коагуляции электролита с учётом его концентрации. В каждую из трёх колб налито по 0,01 л золя хлорида серебра. Для коагуляции этого золя в первую колбу добавлено 0,002 л 1н. NaNO3, во вторую – 0,012 л. 0,01н. Сa(NO3)2; в третью – 0,007 л. 0,001н. Al(NO3)3. Вычислите пороги коагуляции электролитов, определите знак заряда частиц золя. Решение: Минимальное количество электролита, прибавляемого к золю, которое может вызвать коагуляцию золя, называется порогом коагуляции Спор (ммоль/л). Порог коагуляции может быть рассчитан по формуле:
где СЭ - эквивалентная концентрация электролита (моль/л); VЭл , VЗ - соответственно объёмы электролита и золя, л. Вычисляем пороги коагуляции добавляемых электролитов:
Добавляемые электролиты – NaNO3, Ca(NO3)3 и Al(NO3)3 cодержат анион NO3-- и катионы Na+, Ca2+ , Al3+ разной зарядности. Наименьший порог коагуляции у Al(NO3)3, следовательно, частицы золя хлорида серебра заряжены отрицательно. Пример 5. Расчёт порога коагуляции. Пусть молярная концентрация исходного электролита будет равна С, объём его, вызвавший коагуляцию, V; тогда число миллимолей электролита:
Порог коагуляции относится к одному литру золя, и если для его определения было взято w мл золя, то величина порога коагуляции будет:
|

 потенциала или вследствие потери сольватной оболочки.
потенциала или вследствие потери сольватной оболочки. ;
;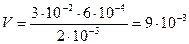 (л) раствора BaCl2
(л) раствора BaCl2

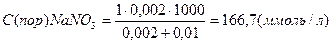

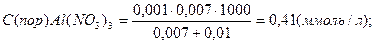
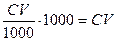 .
.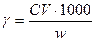 (ммоль/л)
(ммоль/л)


