Произведение растворимости
В насыщенном растворе малорастворимого электролита имеет место равновесие между веществом в растворе и тем же веществом в осадке. Если растворенное вещество – сильный электролит, например соль, то насыщенный раствор содержит ионы этой соли, находящиеся в равновесии с осадком, например: CaCO3 в осадке в растворе Произведение концентраций ионов малорастворимого электролита, содержащихся в его насыщенном растворе, является величиной постоянной при данной температуре. Эта величина называется произведением растворимости ПР: ПР(СаСО3)=[Ca2+]*[CO32-] Если при диссоциации молекулы соли образуется два или более одинаковых иона, концентрации этих ионов в выражении произведения растворимости должны быть возведены в соответствующие степени, например: ПР (Ca3(PO4)2)=[Ca2+]3*[PO43-]2 Произведение растворимости характеризует растворимость твердого электролита при данной температуре. Из двух однотипных солей (например, СaCO3 и BaSO4),большей растворимостью обладает та соль, у которой больше значение произведения растворимости. Если в растворе соли произведение концентраций ионов больше величины произведения растворимости - соль выпадает в осадок: [Ca2+]∙[CO32-]>ПР Если в растворе соли произведение концентраций ионов меньше произведения растворимости – осадка не образуется. [Ca2+]∙[CO32-]<ПР Таким образом, в ненасыщенном растворе произведение концентраций ионов меньше произведения растворимости, в насыщенном растворе они равны, в пересыщенном растворе произведение концентраций ионов больше произведения растворимости. Можно ненасыщенный раствор какого-либо электролита сделать насыщенным и даже пересыщенным, если к нему прибавить сильный электролит с одноименным ионом. Например, если к ненасыщенному раствору CaCO3 добавлять понемногу раствор NaCO3, то ионное произведение постепенно достигнет произведения растворимости и затем превысит его. Начнется выпадение осадка CaCO3. Растворимость труднорастворимого электролита понижается при введении в его раствор какого-либо сильного электролита с Примеры решения задач Пример 1. Произведение растворимости PbJ2 при комнатной температуре равно 1,4*10-8. Определить растворимость этой соли и концентрации каждого из ионов в насыщенном растворе. Решение: PbJ2 диссоциирует по уравнению PbJ2 Из каждой молекулы PbJ2 получается один ион Pb+ и два иона J-. Обозначим молярную концентрацию насыщенного раствора PbJ2 через Х, тогда: [PbJ2]=X; [Pb2+]=X; [J-]=2X В насыщенном растворе соли произведение концентраций ионов равно произведению растворимости: [Pb2+]*[J-]2=ПР Подставим в это уравнение концентрации ионов, выраженные через Х и получим: Х*(2Х)2=ПР 4*Х2=1,4*10-8 4*Х3=1,4*10-8 Х= Растворимость PbJ2 равна 1,5*10-3 моль/л; концентрации ионов [Pb2+]=1,5*10-3 моль/л, [J-]=2*1,5*10-3=3*10-3 моль/л. Пример 2. Растворимость Ag3PO4 в воде при 20 oС равна 0,0065 г/л. Рассчитайте величину произведения растворимости. Решение: Молярная масса Ag3PO4 равна М(Ag3PO4)=3*108+31+16*4=319 г/моль Растворимость Ag3PO4:
При диссоциации Ag3PO4 образуется три иона Ag+ и один ион PO43-. Концентрации ионов будут: [PO43-]=1,55*10-5моль/л [Ag+]=3*1,55*10-3=4,65*10-5 моль/л Произведение растворимости равно произведению концентраций ионов в насыщенном растворе соли: ПР=[Ag+]3*[PO43-]=(4,65*10-5)3*1,55*10-5=155,8*10-20=1,56*10-18 Пример 3. Произведение растворимости MgS при 25 oС равно 2,0*10-15. Образуется ли осадок MgS при смешивании равных объемов 0,004н Mg(NO3)2 и 0,0006н Na2S? Степень диссоциации этих электролитов считать равным единице. Решение: При смешивании равных объемов растворов объем смеси стал в 2 раза больше каждого из взятых растворов, а концентрация каждого из растворенных веществ уменьшилась вдвое, поэтому: С(Mg(NO3)2)=0,002н С(Na2S)=0,0003н Для определения концентрации ионов Mg2+и S2- переведем нормальную концентрацию растворов в молярную: С(Mg(NO3)2)=0,002н=0,001М С(Na2S)=0,0003н=0,00015М Концентрации ионов Mg2+и S2- будут равны: С(Mg2+)=1*10-3 моль/л; С(S2-)=1,5*10-4 моль/л Определим произведение концентраций ионов Mg2+и S2- и сравним с произведением растворимости. С(Mg2+)* С(S2-)=10-3*1,5*10-4 =1,5*10-7 Это больше ПР, осадок MgS образуется. Пример 4. Произведение растворимости BaSO4 при 25 oС равно 1,08*10-10. Определить при этой температуре концентрацию ионов Ba2+ в насыщенном растворе BaSO4, содержащем Na2SO4 в количестве 0,01 моль/л. Степень диссоциации Na2SO4 равна 88%. Решение: Сульфат натрия – сильный электролит, в водном растворе почти полностью диссоциирует на ионы. Это приводит к тому, что в насыщенном растворе BaSO4 сильно возрастает концентрация ионов SO42- и уменьшается концентрация ионов Ba2+. Сульфат натрия вводит в раствор ионы SO42- в количестве: 0,01*0,88=0,088 моль/л. Добавление Na2SO4 смещает равновесие диссоциации влево, т.е. в сторону кристаллизацииBaSO4: BaSO4 После смещения равновесия концентрация ионов Ba2+и SO42- стали иными, чем до добавления Na2SO4. Обозначим новые концентрации ионов Ba2+и SO42-, образующиеся при диссоциации BaSO4 через Х моль/л. Концентрация ионов SO42- будет (Х+0,0088) моль/л. Величина ПР остается постоянной. Получим: ПР(BaSO4)=Х*(Х+0,0088)=1,08*10-10 Х2+0,0088Х=1,08*10-10 Т.к. величина Х2 очень мала, ею можно пренебречь 0,0088Х=1,08*10-10 Х=0,12*10-7 моль/л Концентрация ионов Ba2+ равна 0,12*10-7 моль/л.
|

 Ca2++CO32-
Ca2++CO32-
 =1,5*10-3
=1,5*10-3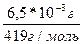 =1,55*10-5 моль/л
=1,55*10-5 моль/л


