Ионное произведение воды. Водородный показатель
В чистой воде незначительная часть молекул Н2О диссоциирована на ионы: Н2О Измерением электропроводности воды установлено, что при t=22 оС концентрация ионов Н+ и ОН- в чистой воде составляет 10-7г-ион/л: [Н+]=[ОН-]= 10-7г-ион/л Произведение концентраций ионов водорода и гидроксила воды называется ионным произведением воды и численно равно 10-14. Ионное произведение воды – величина постоянная не только для воды, но и для разбавленных водных растворов любых веществ. Обозначим эту величину КH2O: КН2О=10-14 1) В нейтральных растворах концентрация ионов водорода и гидроксила одинакова и равна 10-7г-ион/л: [Н+]=[ОН-]= 10-7 г-ион/л 2) В кислых растворах концентрация ионов водорода выше, чем ионов гидроксила: [Н+]>[ОН-] 3) В щелочных растворах концентрация ионов гидроксила выше, чем концентрация ионов водорода: [Н+]<[ОН-] Но как бы ни менялись концентрации ионов водорода и гидроксила, их произведение остается постоянным и равным (при t=22 оC) 10-14. Поэтому, зная концентрацию одного из ионов воды, можно вычислить концентрацию другого иона. Пусть концентрация ионов водорода равна: [Н+] =5*10-4 г-ион/л, тогда концентрация ионов гидроксила: [ОН-]= Реакцию водного раствора принято количественно характеризовать концентрацией ионов водорода. Удобно вместо концентрации ионов водорода указывать взятый с обратным знаком показатель степени, в которую надо возвести число 10, чтобы получить числовое значение концентрации. Эта величина называется водородный показатель и обозначается рН. Математически рН – это десятичный логарифм концентрации ионов водорода, взятый с обратным знаком: рН=-lg[H+] 1) В нейтральном растворе рН = 7; 2) В кислом растворе рН < 7; 3) В щелочном растворе рН > 7 Зная рН раствора, можно вычислить концентрации ионов Н+ и ОН-. И, наоборот, по величине концентрации ионов Н+ и ОН- можно вычислить рН раствора. Примеры решения задач Пример 1. Вычислить водородный показатель – рН водного раствора КОН, содержащегося в растворе с концентрацией 4,2*10-3 моль/л. Решение: Концентрация ионов ОН- равна концентрации самой щелочи в растворе: [OH-] = 4,2 *10-3 г-ион/л Определим концентрацию ионов Н+: [Н+]= Водородный показатель раствора КОН равен: рН=-lg[H+]=-lg 0,24*10-11=11,62.
Пример 2. Определить концентрацию ионов ОН- в растворе, рН которого равен 3,28. Решение: рН= -lg [H+] lg[H+]=-3,28 [H+]=5,25*10-4моль/л или 5,25 *10-4 г-ион/л Концентрация ионов ОН-: [ОН-]=
Пример 3 Определить рН 0,17н раствора СН3СООН, константа диссоциации которой равна 1,75*10-5. Решение: Константа и степень диссоциации слабого электролита связаны между собой законом разбавления Оствальда: α= Определим концентрацию ионов водорода в растворе СН3 СООН: [Н+]=С* α = 0,17*1*10-2= 0,17*10-2 моль/л или 0,17*10-2 г-ион/л Водородный показатель СН3СООН: рН=-lg[H+]=-lg 0,17*10-2=2,77
|

 Н++ОН-
Н++ОН- =
=  =2*10-11 г-ион/л или 2*10-11 моль/л
=2*10-11 г-ион/л или 2*10-11 моль/л =
= 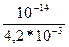 =0,24 *10-11г-ион/л
=0,24 *10-11г-ион/л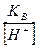 =
=  =0,19*10-10 моль/л или 0,19*10-10 г-ион/л
=0,19*10-10 моль/л или 0,19*10-10 г-ион/л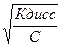 =
= 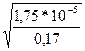 =
=  =10-2
=10-2


