Скорость химических реакций. При определении понятия скорости химической реакции необходимо различать гомогенные и гетерогенные реакции
При определении понятия скорости химической реакции необходимо различать гомогенные и гетерогенные реакции. Если реакция протекает в гомогенной системе, например, в растворе или в смеси газов, то она идет во всем объеме системы. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы. Поскольку отношение числа молей вещества к объему, в котором оно распределено, есть молярная концентрация вещества, скорость гомогенной реакции можно также определить как изменение концентрации в единицу времени какого-либо из веществ: исходного реагента или продукта реакции. Чтобы результат расчета всегда был положительным, независимо, от того, производится он по реагенту или продукту, в формуле используется знак «±»:
В зависимости от характера реакции время может быть выражено не только в секундах, как требует система СИ, но также в минутах или часах. В ходе реакции величина ее скорости не постоянна, а непрерывно изменяется: уменьшается, так как уменьшаются концентрации исходных веществ. Вышеприведенный расчет дает среднее значение скорости реакции за некоторый интервал времени Δτ = τ2 – τ1. Истинная (мгновенная) скорость определяется как предел к которому стремится отношение Δ С / Δτ при Δτ → 0, т. е. истинная скорость равна производной концентрации по времени. Для реакции, в уравнении которой есть стехиометрические коэффициенты, отличающиеся от единицы, значения скорости, выраженные по разным веществам, неодинаковы. Например для реакции А + 3В = D + 2Е расход вещества А равен одному молю, вещества В – трем молям, приход вещества Е – двум молям. Поэтому υ;(А) = ⅓ υ;(В) = υ;(D) =½ υ;(Е) или υ;(Е). = ⅔ υ;(В). Если реакция протекает между веществами, находящимися в различных фазах гетерогенной системы, то она может идти только на поверхности раздела этих фаз. Например, взаимодействие раствора кислоты и куска металла происходит только на поверхности металла. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности раздела фаз:
Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени, равные коэффициентам при формулах этих веществ в уравнении реакции. Тогда для реакции 2А + В → продукты справедливо соотношение υ; ~ · С А2· С В, а для перехода к равенству вводится коэффициент пропорциональности k, называемый константой скорости реакции: υ; = k · С А2· С В = k ·[А]2·[В] (молярные концентрации в формулах могут обозначаться как буквой С с соответствующим индексом, так и формулой вещества, заключенной в квадратные скобки). Физический смысл константы скорости реакции – скорость реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Размерность константы скорости реакции зависит от числа сомножителей в правой части уравнения и может быть с–1; с–1·(л/моль); с–1·(л2/моль2) и т. п., то есть такой, чтобы в любом случае при вычислениях скорость реакции выражалась в моль·л–1·с–1. Для гетерогенных реакций в уравнение закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, представляет постоянную величину и входит в константу скорости, например, для процесса горения угля С + О2 = СО2 закон действия масс записывается: υ; = kI ·const·[O2]·= k ·[O2], где k = kI ·const. В системах, где одно или несколько веществ являются газами, скорость реакции зависит также и от давления. Например, при взаимодействии водорода с парами иода H2 + I2 =2HI скорость химической реакции будет определяться выражением: υ; = k ·[H2]·[I2]. Если увеличить давление, например, в 3 раза, то во столько же раз уменьшится объем, занимаемый системой, и, следовательно, во столько же раз увеличатся концентрации каждого из реагирующих веществ. Скорость реакции в этом случае возрастет в 9 раз Зависимость скорости реакции от температуры описывается правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2‑4 раза. Это означает, что при повышении температуры в арифметической прогрессии скорость химической реакции возрастает в геометрической прогрессии. Основанием в формуле прогрессии является температурный коэффициент скорости реакции γ, показывающий, во сколько раз увеличивается скорость данной реакции (или, что то же самое – константа скорости) при росте температуры на 10 градусов. Математически правило Вант-Гоффа выражается формулами:
где
где Примеры решения задач Пример 1. Как изменится скорость реакции 2СO + О2 = 2СО2, протекающей в закрытом сосуде, если увеличить давление в 2 раза? Решение: Скорость указанной химической реакции определяется выражением: υ;нач = k ·[СО]2·[О2]. Увеличение давления приводит к увеличению концентрации обоих реагентов в 2 раза. С учетом этого перепишем выражение закона действующих масс: υ;1 = k ·[2СО]2·[2О2] = k ·22[СО]2·2[О2] = 8 k ·[СО]2·[О2] = 8 υ;нач .
Ответ: Скорость реакции увеличится в 8 раз. Пример 2. Вычислить, во сколько раз увеличится скорость реакции, если повысить температуру системы от 20 °С до 100 °С, приняв значение температурного коэффициента скорости реакции равным 3. Решение: Отношение скоростей реакции при двух разных температурах связано с температурным коэффициентом и изменением температуры формулой:
Вычисление:
Ответ: Скорость реакции увеличится в 6561 раз. Пример 3. При изучении гомогенной реакции А + 2В = 3D установлено, что в течение 8 минут протекания реакции количество вещества А в реакторе уменьшилось с 5,6 моль, до 4,4 моль. Объем реакционной массы составлял 56 л. Вычислить среднюю скорость химической реакции за исследованный промежуток времени по веществам А, В и D. Решение: Используем формулу в соответствии с определением понятия «средняя скорость химической реакции» и подставляем численные значения, получая среднюю скорость по реагенту А:
Из уравнения реакции следует, что по сравнению со скоростью убыли вещества А скорость убыли вещества В вдвое больше, а скорость увеличения количества продукта D – втрое больше. Следовательно: υ;(А) = ½ υ;(В) =⅓ υ;(D) и тогда υ;(В) = 2 υ;(А) = 2·2,68·10–3 = 6, 36·10–3 моль·л–1·мин–1; υ;(D) = 3 υ;(А) = 3·2,68·10–3 = 8, 04·10–3 моль·л–1·мин–1 Ответ: υ;(А) =2,68·10–3 моль·л–1·мин–1; υ;(В) = 6, 36·10–3 моль·л–1·мин–1; υ;(D) = 8, 04·10–3 моль·л–1·мин–1. Пример 4. Для определения константы скорости гомогенной реакции А + 2В → продукты было проведено два опыта при различных концентрациях вещества В и измерена скорость реакции.
Концентрация вещества А поддерживалась постоянной и равной 1 моль/л. Вычислить среднее значение константы скорости реакции и указать размерность константы скорости. Решение: Скорость указанной химической реакции определяется выражением: υ; = k ·[А]·[В]2, откуда константа скорости: k = υ / [А]·[В]2. Производим расчет по данным двух измерений: k 1=1,050·10–6 моль·л–1·с–1 / (1 моль/л·(0,1 моль/л)2) = 1,050·10–8 л2·моль–2·с–1; k 2=9,540·10–6 моль·л–1·с–1 / (1 моль/л·(0,3 моль/л)2) = 1,060·10–8 л2·моль–2·с–1; и определяем среднее значение константы скорости реакции: k = (k 1+ k 2)/2= (1,050·10–8 + 1,060·10–8)/2 = 1,055·10–8 л2·моль–2·с–1. Ответ: k = 1,055·10–8 л2·моль–2·с–1.
|

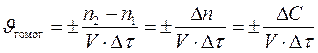
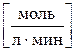 .
.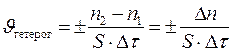
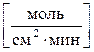 .
.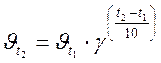 или
или 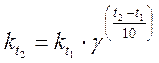
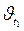 и
и 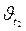 – скорости реакции соответственно при начальной t 1 и конечной t 2 температурах. Правило Вант-Гоффа может быть также выражено следующими соотношениями:
– скорости реакции соответственно при начальной t 1 и конечной t 2 температурах. Правило Вант-Гоффа может быть также выражено следующими соотношениями: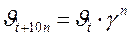 ;
; 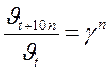 ;
; 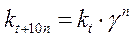 ;
; 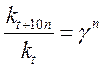 ,
,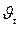 и
и 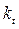 – соответственно скорость и константа скорости реакции при температуре t;
– соответственно скорость и константа скорости реакции при температуре t; 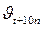 и
и 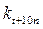 – те же величины при температуре t +10 n; n – число «десятиградусных» интервалов (n =(t 2– t 1)/10), на которые изменилась температура (может быть числом целым или дробным, положительным или отрицательным).
– те же величины при температуре t +10 n; n – число «десятиградусных» интервалов (n =(t 2– t 1)/10), на которые изменилась температура (может быть числом целым или дробным, положительным или отрицательным).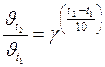
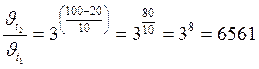
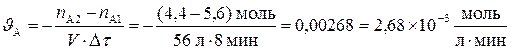 .
.


