Способы выражения концентрации растворов
Раствором называется гомогенная система, состоящая из двух или нескольких компонентов, относительное содержание которых может меняться в широких пределах. Вещество, находящееся в растворе в большем количестве называется растворителем. Вещество, содержание которого меньше, называется растворённым веществом. Концентрацией раствора называется содержание растворённого вещества в определённой массе или в определённом объёме раствора или растворителя. Наиболее часто используют следующие способы выражения концентрации раствора. Весовые концентрации 1. Массовая доля (процентная концентрация по массе) показывает долю растворенного вещества от массы всего раствора, то есть численного равна массе растворенного вещества в 100 г раствора:
где mвещества – масса растворённого вещества, г; mраствора – масса раствора, г; mрастворителя – масса растворителя, г. Масса раствора может быть определена по формуле:
где V – объём раствора, л, мл; ρ – плотность раствора, г/л, г/мл. 2. Молярная (мольная) доля вещества – величина, равная отношению количества этого вещества (nвещества) к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель (nрастворителя):
3. Моляльная концентрация или моляльность – величина, равная количеству растворённого вещества в 1 кг растворителя:
где Mвещества – молярная масса растворённого вещества, г/моль. Объёмные концентрации 1. Объёмная доля растворённого вещества – величина, равная отношению объёма растворённого вещества (Vвещества) к объёму раствора (Vраствора):
2. Молярная концентрация или молярность показывает количество растворённого вещества, содержащееся в одном литре раствора:
где nвещества – количество растворённого вещества, моль; Vраствора – объём раствора, л. Раствор, в 1 литре которого содержится 1 моль растворённого вещества, называется одномолярным раствором и обозначается 1М. 3. Эквивалентная (нормальная) концентрация или нормальность – величина, равная количеству эквивалентов растворённого вещества в одном литре раствора:
где nEQ – количество эквивалентов растворённого вещества, моль; Эвещества – молярная масса эквивалента, г/моль. Иногда вместо обозначения (моль/л) допускается обозначение «н.», например, 1н. или 0.2н. Раствор, в 1 литре которого содержится 1 моль эквивалента вещества, называется нормальным. Эквивалентной концентрацией удобно пользоваться при вычислении объёмов реагирующих друг с другом растворов. В соответствии с законом эквивалентов растворы одинаковой эквивалентной концентрации реагируют в равных объёмах. Если реагируют растворы различной эквивалентной концентрации, то объёмы таких растворов обратно пропорциональны их эквивалентной концентрации:
4. Титр – величина, равная массе растворённого вещества в 1 мл раствора:
Определение молярных масс эквивалентов Эквивалент элемента или вещества определяется его массой, которая замещается или соединяется с количеством вещества в 1 моль атомарного водорода или 0.5 моль атомарного кислорода. Число, показывающее, какая часть моля элемента или вещества эквивалентна 1 моль атомарного водорода, называется фактором эквивалентности. Это безразмерная величина, обозначаемая fEQ. Фактор эквивалентности некоторых веществ можно рассчитать по простым формулам. Для элемента в его соединении: fEQ = 1/|степень окисления элемента в соединении|. Например, для фосфора в оксиде фосфора (III) P2O3 fEQ=1/3, а в оксиде фосфора (V) P2O5 fEQ=1/5. Для кислот фактор эквивалентности равен обратной величине её основности (количество ионов водорода в молекуле кислоты, которое замещается на металл). Фактор эквивалентности для основания равен обратной величине его кислотности (число гидроксид- групп в молекуле основания, которые в реакции замещаются на кислотные остатки). Для солей фактор эквивалентности определяется по формуле: fEQ=1/(r×|z|), где r – количество и z – заряд замещённых катионов или анионов. Определение фактора эквивалентности по химической формуле: - для кислот f(HCl) = 1; f(H2SO4) = 1/2; f(H3PO4) = 1/3; - для оснований f(NaOH) = 1; f(Zn(OH)2) = 1/2; f(Al(OH)3) = 1/3; - для солей f(NaCl) = 1/(1×1) = 1; f(Fe 12 +SO4) = 1/(1×2) = 1/2; f(Al 23 +(SO4)3) = 1/(2×3) = 1/6; f(Na 61 +TeO6) = 1/(6×1) = 1/6. Для солеобразующих оксидов (основных, кислотных, амфотерных) фактор эквивалентности определяется числом катионов соответствующего оксиду основания или анионов соответствующей оксиду кислоты и их зарядом, например, в реакции между оксидом фосфора (V) и оксидом кальция P2O5 + 3CaO → Ca3(PO4)2 фактор эквивалентности P2O5, образующего два трёхзарядных фосфат-иона (PO4)3-, равен 1/6, а для CaO, дающего один двухзарядный катион (Са2+), 1/2. Молярная масса эквивалента вещества, Эвещества – произведение фактора эквивалентности fEQ на молярную массу этого вещества:
Молярную массу эквивалента называют эквивалентной массой или просто эквивалентом. Количество эквивалентов вещества – отношение массы вещества к молярной массе его эквивалента:
Примеры решения задач Пример 1. Имеется раствор Al2(SO4)3 с массовой долей ω=0.1 и плотностью ρ=1,105 г/см3. Каковы молярная, нормальная концентрации, титр, моляльность и молярная доля вещества этого раствора? Решение: 1. Найдём молярную концентрацию раствора. Так как
2. Найдём нормальную концентрацию раствора. Так как
3. Найдём титр раствора.
Поскольку размерность титра г/мл, плотность в расчётную формулу надо подставлять в г/мл, т.е. 1,105 г/мл. 4. Найдём моляльность раствора.
Из формулы видно, что необходимо найти массу растворенного вещества в 1 кг растворителя. Пользуясь определениями моляльной и процентной концентраций, составим следующую пропорцию:
где х – масса растворённого вещества в 1 кг растворителя:
5. Найдём молярную долю растворённого вещества в растворе.
Ответ: молярная концентрация 0.32 моль/л, нормальная концентрация 1.92 моль/л, титр 0.1105 г/мл, моляльность 0.325 моль/кг, молярная доля 0.0058. Пример 2. Чему равна массовая доля 0.2 М раствора (NH4)2SO4 с плотностью ρ=1,015 г/мл? Решение: Масса 1 л раствора: mраствора= 1.015 г/мл • 1000 мл = 1015 г. Масса соли, содержащейся в 1 л раствора (из определения молярной концентрации): mвещества = СМ • Mвещества = 0.2 • 132 = 26, 4 г, где 132 г/моль – молярная масса сульфата аммония. Откуда массовая доля растворённого в растворе вещества:
Ответ: массовая доля растворённого в растворе вещества 0.026 (процентная концентрация 2,6%). Пример 3. Какой объём 96% серной кислоты (ρ=1,84 г/см3) надо взять для приготовления 1 л 0.5 н. раствора? Решение: 1. Определим массу серной кислоты в 1 л раствора:
2. Определим, в каком объёме 96% раствора серной кислоты содержится 24,5 г серной кислоты:
Ответ: для приготовления 1 л 0.5 н. раствора серной кислоты необходимо взять 13,96 мл 96% раствора серной кислоты. Пример 4. Какой объём воды надо прибавить к 200 мл 68% раствора азотной кислоты плотностью 1400 г/л, чтобы получить 10% раствор? Решение: 1. Определим массу азотной кислоты в 200 мл 68% раствора (200 мл = 0.2 л):
2. В полученном 10% растворе масса растворённой азотной кислоты будет такой же, так как для приготовления нового раствора в исходный добавляется вода - растворитель, но не растворённое вещество. Определим массу 10% раствора азотной кислоты:
3. Определим объём добавляемой воды как разность массы 10% раствора (она больше за счёт разбавления водой) и 68% раствора:
Ответ: для приготовления 10% раствора азотной кислоты необходимо добавить 1624 мл воды к 200 мл 68% исходного раствора азотной кислоты.
|

 , %, или
, %, или ,
, ,
, .
. , моль/кг,
, моль/кг, .
. , моль/л,
, моль/л, , моль/л,
, моль/л,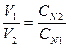 .
. , г/мл.
, г/мл. , г/моль.
, г/моль. , моль.
, моль.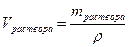 ,
,  , то
, то 
 моль/л. Плотность раствора необходимо пересчитать и подставить в расчётную формулу в г/л: 1,105 г/см3 = 1,105 г/мл = 1105 г/л.
моль/л. Плотность раствора необходимо пересчитать и подставить в расчётную формулу в г/л: 1,105 г/см3 = 1,105 г/мл = 1105 г/л. г/моль, то
г/моль, то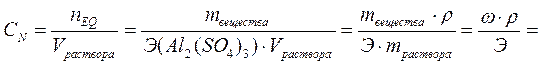
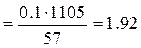 моль/л или 1.92 н.
моль/л или 1.92 н.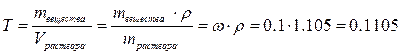 г/мл.
г/мл. .
. г/кг.
г/кг. моль/кг.
моль/кг.
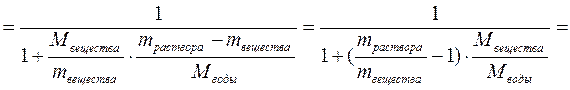

 или 2,6%.
или 2,6%.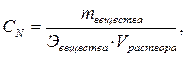 откуда
откуда  г.
г. ,
, мл.
мл. , отсюда
, отсюда г.
г.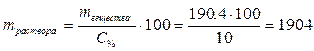 г.
г.
 мл или 1.624 л.
мл или 1.624 л.


