Электрохимические процессы
Электродвижущая сила (ЭДС) гальванического элемента. Максимальная разность равновесных потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой: U= Eк – Eа, где Eк(а) – потенциал катода (анода), В. Уравнение электродного потенциала (уравнение Нернста). При стандартных условиях (температура 298,15 К или 25 оС, давление 101,325 кПа или 1 атм, молярная концентрация раствора электролита 1 моль/л) потенциалы электродов имеют определённый стандартные значения. Если концентрация электролита или температура отличны от стандартных, электродные потенциалы можно рассчитать исходя из стандартных потенциалов Е0 по уравнения Нернста:
где R = 8,3144 Дж/(моль´К) – универсальная газовая постоянная; Т – термодинамическая температура, К; z – заряд иона; F = 96485 Кл/моль, постоянная Фарадея; а – активность ионов в растворе, моль/л. Активность ионов в растворе чаще всего считают равной молярной концентрации раствора. Если температура электролита равная 25 оС, то можно пользоваться следующим уравнением:
Электролиз. При определении продуктов электролиза водных растворов электролитов следует учитывать, что: 1) на катоде в первую очередь восстанавливаются наиболее сильные окислители (идёт реакция с наиболее положительным потенциалом); 2) на аноде в первую очередь окисляются наиболее сильные восстановители (идёт реакция с наиболее отрицательным потенциалом); 3) совместный заряд ионов или ионизация ионов, молекул возможна при относительно малом отличии потенциалов. Во многих случаях электролиза применяют растворимые аноды из металла, восстанавливаемого на катоде. Нерастворимыми являются аноды из золота, платиновых металлов, графита, диоксида свинца, титана, оксида рутения и других веществ. Законы Фарадея (законы электролиза). Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит электричества выражается двумя законами Фарадея. Первый закон Фарадея. Масса вещества, выделившегося на электроде при электролизе, прямо пропорциональна количеству электричества, прошедшего через электролит:
где m – масса вещества, г; Q – количество электричества, Кл ( k – электрохимический эквивалент, то есть масса вещества, выделившаяся при прохождении одного кулона электричества, г/Кл. Второй закон Фарадея. Одинаковое количество электричества выделяют при электролизе на электродах эквивалентные массы различных веществ. Для выделения одного моля (грамм-эквивалента) любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл, называемое числом Фарадея:
где Э – химический эквивалент вещества, г/моль; F – число Фарадея, Кл/моль, F = 96485 Кл/моль. Из первого и второго законов Фарадея вытекает объединённое уравнение: При протекании на электроде нескольких реакций на превращение j вещества тратится определённая доля количества электричества, называемая выходов вещества j по току, и определяемая из выражения:
где Qj – количество электричества, израсходованное на превращение j вещества. Примеры решения задач Пример 1. Нарисовать схему гальванического элемента. Указать анод и катод, написать уравнения электродных процессов. Рассчитать ЭДС гальванического элемента при заданных концентрациях электролитов и значениях температуры. Zn êZn2+ (0.02н.) êêAg+ (0.001М) êAg, t=25 оС Решение:

Сравнивая стандартные потенциалы восстановления цинка и серебра, получаем, что катодом в указанном гальваническом будет выступать серебряный электрод, а анодом – цинковый. Анодный процесс: Zn0 – 2e- ® Zn2+, катодный процесс: Ag+ + e- ® Ag0. ЭДС гальванического элемента рассчитываем по формуле U= Eк – Eа, а потенциалы катода и анода по уравнению Нернста
Предварительно необходимо пересчитать нормальную концентрацию, указанную для цинкового электролита, в молярную: 0.02 / 2 = 0.01 моль/л (т.к. в окислении цинка участвует два электрона).
Пример 2. Написать уравнения электрохимических процессов, происходящих на аноде и катоде при электролизе раствора бромида меди (II) (анод инертный). Решение: В водном растворе CuBr2 диссоциирует следующим образом: CuBr2 «Cu2+ + 2Br-. Стандартный электродный потенциал водородного электрода в нейтральной водной среде 2H2O + 2e- ® H2 + 2OH- (-0.41 В) значительно отрицательнее потенциала системы Сu2+ + 2e- ® Cu0 (+0.34 В). Поэтому на катоде будет происходить электрохимическое осаждение меди Сu2+ + 2e- ® Cu0. На аноде будет происходить окисление ионов брома, приводящее к выделению жидкого брома Br- - e- ® Br0, 2Br ® Br2. поскольку электрохимическое окисление воды из нейтральных сред 2H2O – 4e- ® O2 + 4H+ может протекать при потенциалах не менее +1.23 В, что выше стандартного электродного потенциала, характеризующего выделение жидкого брома (+1.07 В).
Пример 3. Написать уравнения электрохимических процессов, происходящих на аноде и катоде при электролизе раствора сульфата натрия (анод инертный). Решение: В водном растворе Na2SO4 диссоциирует следующим образом: Na2SO4 «2Na+ + SO42-. Стандартный электродный потенциал системы Na+ + e- ® Na0 (-2.71 В) значительно отрицательнее потенциала водородного электрода в нейтральной водной среде (-0.41 В). Поэтому на катоде будет происходить электрохимическое разложение воды с выделением водорода 2H2O + 2e- ® H2 + 2OH-, а ионы натрия, приходящие к катоду будут накапливаться в прилегающей к нему части раствора (катодное пространство). У катода накапливается щелочь NaOH. На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода 2H2O – 4e- ® O2 + 4H+, поскольку отвечающей этой системе стандартный электродный потенциал (+1.23 В) значительно ниже, чем стандартный электродный потенциал (+2.01 В), характеризующий систему 2SO42- – 2e- ® S2O82-. Сульфат-ионы, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве. У анода накапливается кислота H2SO4.
Пример 4. Написать уравнения электрохимических процессов, происходящих на катоде и цинковом аноде при электролизе раствора сульфата цинка. Решение: В водном растворе ZnSO4 диссоциирует следующим образом: ZnSO4 «Zn2+ + SO42-. Стандартный электродный потенциал системы Zn2+ + 2e- ® Zn0 (-0.76 В) близок к потенциалу водородного электрода в нейтральной водной среде (-0.41 В), поэтому на катоде будут совместно протекать два процесса восстановления: Zn2+ + 2e- ® Zn0 и 2H2O + 2e- ® H2 + 2OH-. На аноде возможно протекание трёх окислительных процессов: электрохимическое окисление воды, приводящее к выделению кислорода (+1.23 В), окисление сульфат-ионов (+2.01 В) и окисление материала анода – цинка (-0.76 В). Сравнение электродных потенциалов систем позволяет сделать вывод об окислении анода и выделении ионов цинка в раствор Zn0 - 2e- ® Zn2+.
Пример 5. Определите массу цинка, которая выделится на катоде при электролизе раствора сульфата цинка в течение одного часа при токе 26.8 А, если выход цинка по току равен 50%. Решение: Согласно закону Фарадея, Масса моля эквивалентов (химический эквивалент вещества) цинка в ZnSO4 равна 65.38: 2 = 32.69 г/моль. Не забыв выразить время в секундах, подставим в уравнение закона Фарадея все известные значения и определим массу цинка, которая должна выделиться (при условии, если весь ток будет израсходован на выделение цинка):
Так как выход по току цинка составляет 50%, то практически на катоде выделится цинка Пример 6. Рассчитайте ток при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1.4 л водорода, измеренного при нормальных условиях. Решение: Согласно закону Фарадея имеем, Так как количество водорода дано в объёмных единицах, то отношение
Пример 7. Сколько граммов гидроксида калия образовалось у катода при электролизе раствора сульфата калия, если на аноде выделилось 11.2 л кислорода, измеренного при нормальных условиях. Решение: Объём моля эквивалентов кислорода (в нормальных условиях) равен 22.4 / 4 = 5.6 л (так в процессе электрохимического выделения кислорода участвует 4 электрона: в щелочной среде 4OH- - 4 e- ® O2 + 2H2O, а в кислой и нейтральной среде 2H2O – 4 e- ® O2 + 4H+). Следовательно, 11.2 л кислорода составляет 2 моля эквивалентов. По второму закону Фарадея столько же, 2 моля эквивалентов KOH образовалось у катода или 56.11 ´ 2 = 112.22 г (56.11 г – масса одного моля эквивалентов KOH).
Пример 8. Ток силой 6 А пропускали через водный раствор серной кислоты в течение 1.5 часа. Вычислить массу разложившейся воды и объём выделившихся кислорода и водорода в нормальных условиях. Решение: На аноде в кислой среде протекает процесс разложения воды с выделением кислорода: H2O – 2 e- ® 0.5O2 + 2H+ (расчет необходимо выполнять на одну молекулы воды), поэтому молярная масса эквивалента воды Э = 18 / 2 = 9 г/моль. Масса разложившейся воды:
Для определения объёма выделившихся газов преобразуем, полученную ранее формулу (см. задачу 6):
Так как
|

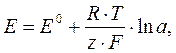

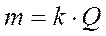
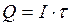 , I – сила тока, А, t - время, с);
, I – сила тока, А, t - время, с);

 ,
,
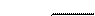

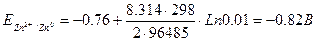 ,
, ,
,
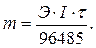
 г.
г. г.
г.
 заменяем отношением
заменяем отношением  , где
, где  - объём водорода, л;
- объём водорода, л;  - объём моля эквивалентов водорода, л. Тогда
- объём моля эквивалентов водорода, л. Тогда 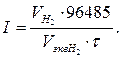 Объём моля эквивалентов водорода при нормальных условиях равен половине моля молекул водорода
Объём моля эквивалентов водорода при нормальных условиях равен половине моля молекул водорода  л, так как моль любого газа в нормальных условиях занимает объём равный 22.4 л, а в процессе электрохимического восстановления водорода (2H2O + 2 e- ® H2 + 2OH- или в кислых средах 2H+ + 2 e- ® H2) участвует два электрона. Подставив в приведённую формулу числовые значения, получим
л, так как моль любого газа в нормальных условиях занимает объём равный 22.4 л, а в процессе электрохимического восстановления водорода (2H2O + 2 e- ® H2 + 2OH- или в кислых средах 2H+ + 2 e- ® H2) участвует два электрона. Подставив в приведённую формулу числовые значения, получим А.
А. г.
г.
 л (2H2O – 4 e- ® O2 + 4H+), поэтому
л (2H2O – 4 e- ® O2 + 4H+), поэтому л,
л, л.
л.


