Решение типовых задач
Задача 1. Написать уравнение электролиза раствора KCl, если анод нерастворимый.
Катод (-) Анод (+) 2H2O+2e↔ H2↑+2OH 2Cl-2e↔Cl2 Суммарное ионное уравнение: 2Н2О + 2С1 → Н2↑ + С12↑ + 2ОН- Суммарное молекулярное уравнение: 2КС1 + 2Н2О→ 2Н2↑ + С2↑+ 2КОН Вторичный продукт электролиза Задача 2. Написать уравнение реакции электролиза водного раствора AgNO3, если а) анод нерастворимый; б) анод растворимый, серебряный. Решение: а) анод нерастворимый AgNO3↔ Ag + + NO3- катод(-)…………………………………….анод(+)
Суммарное уравнение процессов: 4AgNO3 + 2H2O→4Ag + О2+4 HNO 3 Вторичный продукт электролиза б) анод растворимый, серебряный
Суммарное уравнение электролиза с растворимым анодом написать нельзя. Расчет количества веществ, разложенных или образовавшихся в процессе электролиза, производится по закону Фарадея. Теоретически массы веществ, испытавших изменение при электролизе, определяются
Q – количество прошедшего электричества m – масса вещества, г.
J – сила тока, А
Пример: Сколько меди выделяется при пропускании через раствор ее соли тока силой 6А, в течение 1 часа, если выход по току составляет 98%? m(Си)факт = m(Си)теор*0,98 = Следовательно, на катоде выделится 7 грамм меди.
|

 Решение: KCl↔K+ +Cl-
Решение: KCl↔K+ +Cl- Ag++1e→Ag0 2H2O-4e→O2+4H+
Ag++1e→Ag0 2H2O-4e→O2+4H+ катод(-) анод(+)
катод(-) анод(+) Ag++1e→Ag Ag0-1e→Ag+
Ag++1e→Ag Ag0-1e→Ag+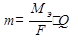
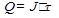
 - химический эквивалент вещества, г.
- химический эквивалент вещества, г. - время электролиза, сек.
- время электролиза, сек.


