Первый закон термодинамики
В изолированной системе сумма всех видов энергии есть величина постоянная. Если к системе подведено некоторое количество теплоты Q, то оно может быть израсходовано на изменение внутренней энергии системы
Под внутренней энергией системы U подразумевают ее общий запас, обусловленный всеми видами движений и взаимодействий состояний её молекул и атомов. В эту энергию включается поступательное, колебательное и вращательное движение молекул, атомов, ионов, энергии силового взаимодействия и все другие виды энергии, кроме кинетической (перемещение всей системы в целом) и потенциальной (взаимодействие с внешними силовыми полями). В любом процессе приращение внутренней энергии равно:
Если происходит химическая реакция, то работа совершается против внешних сил (давления):
Подставим выражения 2 и 3 в формулу 1:
Выражение постоянном давлении. Т.е.
Н > 0 «+» - для эндотермических реакций (поглощение тепла). Н < 0 «–» - для экзотермических (выделяется тепло). Знак теплового эффекта определяется тем, с какой стороны рассматриваем процесс: со стороны окружающей среды, или изнутри химической системы. Если со стороны окружающей среды, то знак «+» соответствует экзотермическому процессу, когда среда получает тепло от химической системы. В дальнейшем мы будем пользоваться термодинамической системой знаков, то есть рассматривать процесс с точки зрения системы. Тогда экзотермической реакции будет соответствовать знак «–», поскольку система теряет энергию в виде тепла. Экзотермический процесс Эндотермический процесс С помощью изменения Измеряется в ккал/моль или кДж/моль; Например: кДж/моль; Обозначает, что при образовании 1 моля жидкой воды при стандартных условиях, выделяется -285,3 кДж тепла на каждый моль вещества. Энтальпия простых веществ равна 0. Экзотермические соединения более устойчивы, чем исходные простые вещества, так как при их образовании выделяется тепло. Другим важным выражением закона сохранения энергии является закон Гесса.
|

 и на совершение системой внешней работы А.
и на совершение системой внешней работы А. (1)
(1) (2)
(2) (3)
(3)
 - энтальпия (H) или теплосодержание системы при
- энтальпия (H) или теплосодержание системы при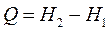
 - внутренняя энергия до реакции;
- внутренняя энергия до реакции; - внутренняя энергия после реакции;
- внутренняя энергия после реакции;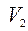 - объём после реакции;
- объём после реакции; - объём до реакции;
- объём до реакции; - энтальпия системы после реакции;
- энтальпия системы после реакции; - до реакции;
- до реакции;
 ;
;
 ;
; характеризуется не только реакции, но и отдельные соединения. Для этого применяется понятие о стандартной энтальпии образования
характеризуется не только реакции, но и отдельные соединения. Для этого применяется понятие о стандартной энтальпии образования  - это количество теплоты, которое выделяется или поглощается при образовании 1 моля cложного соединения из простых веществ (элементов), причем и само соединение и элементы находятся в том агрегатном состоянии, в котором они устойчивы, в так называемых стандартных условиях (при давлении
- это количество теплоты, которое выделяется или поглощается при образовании 1 моля cложного соединения из простых веществ (элементов), причем и само соединение и элементы находятся в том агрегатном состоянии, в котором они устойчивы, в так называемых стандартных условиях (при давлении  Па и при T= 298° К);
Па и при T= 298° К); кДж/моль;
кДж/моль; 



