Второй закон термодинамики.
Самопроизвольный процесс, происходящий без изменения энергетического запаса системы совершается только в направлении, при котором энтропия возрастает (S>О); Австрийским физиком Больцманом было установлено
Энтропия - это логарифмическое выражение вероятности существования системы. R - универсальная газовая постоянная = 8,314 Дж/моль К; N - постоянная Авогадро ( Следовательно, чем большим числом макрочастиц представлена рассматриваемая макросистема, тем больше вариантов распределение этих частиц, при которых может быть достигнуто макросостояние, тем выше значение энтропии. 1. С повышением температуры энтропия возрастает, так как усиливается неупорядоченность, хаос в системе, т.е.:
2. Энтропия скачкообразно увеличивается при переходе вещества (кристаллического) в жидкое, т.е. в процессе плавления:
Для веществ в кристаллическом состоянии характерна упорядоченность частиц и наличие ближнего и дальнего порядка. Частицы расположены в строгой последовательности. Зависимость энтропии от температуры t можно выразить графиком:
Здесь необходима различать постепенное изменение энтропии ( 3. Процессы — нагревания, кипения, диссоциации, вызывающие увеличение беспорядка сопровождаются увеличением энтропии. 4. Кристаллизация, полимеризация связана с уменьшением объема, сопровождаются уменьшением энтропии. 5. Чем тверже вещество, тем меньше его энтропия, чем мягче, тем энтропия больше. По группам сверху вниз наблюдается увеличение энтропии. В отличие от всех других термодинамических функций энтропия имеет абсолютное значение.
|

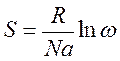
 );
);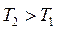 , то
, то 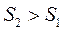
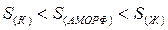
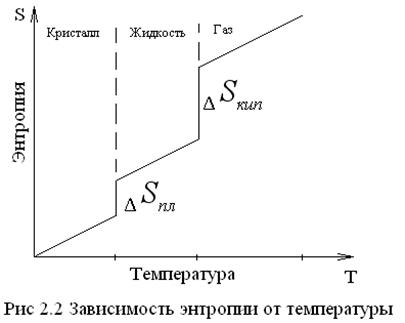
 ) за счет изменения параметров состояния (Т) и скачкообразное – в результате фазовых переходов и химических реакций.
) за счет изменения параметров состояния (Т) и скачкообразное – в результате фазовых переходов и химических реакций.


