Анализ уравнения Гиббса.
1. DH < 0 DS > 0, то DG < 0 экзотермическая - с увеличением энтропии - идет самопроизвольно; 2. DН > О DS < О, то DG > О эндотермическая с уменьшением энтропии - реакция невозможна; Во всех остальных случаях DН > О, DS > 0 и DH < 0 и DS < 0 знак DG будет зависеть от соотношения значений DН и DS. а) При очень низких температурах
б) При обычных температурах величина ТDS для большинства реакций меньше DН поэтому при этих температурах экзотермические реакции (DН < О) протекают самопроизвольно, а эндотермические (DН > О) вынужденно. Согласно уравнению DG=DН - ТDS при понижении температуры преобладает энтальпийный фактор, при повышении наоборот энтропийный. Вот почему при одних температурах реакция будет протекать слева направо (DG < О), а при других - справа налево DG> О. Т.е. процесс неосуществимый; в) При очень высоких температурах величина T∆S становится значительно больше DН и тогда знак DG определяется членом TDS DG = -TDS Следовательно, при очень высоких температурах энтропийный фактор преобладает, над энтальпийным. Поэтому для осуществления процессов ассоциации нужны низкие температуры, а для разложения - высокие температуры. При высоких температурах возможно самопроизвольное протекание эндотермических реакций. г) Если соблюдается равенство DН = TDS, тo стремление частиц к упорядочению, определяемое величиной DН и стремление к беспорядку, определяемое величиной TDS, компенсируют друг друга т.е. совокупность веществ находится равновесии DG = О; Таким образом необходимым условием протекания процесса является отрицательное по знаку изменения энергии Гиббса. Если DG>О, то такой процесс невозможен. При одинаковых знаках DН и DS, процесс обратимый DG=О. 2.2 Классификация химических реакций в химической кинетике. Гомо- и гетерогенные реакции. Скорость химической реакции. Факторы, влияющие на скорость химической реакции. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действия масс. Константа скорости. Зависимость скорости реакции от температуры. Правило Вант – Гоффа. Раздел химии, посвященный изучению скоростей и механизмов химических реакций называется химической кинетикой. Скорость химических реакций изменяется в широких пределах. Так, для заверения химических процессов, происходящих при взрыве тротила, нитроглицерина, гремучей ртути и др. достаточно миллионных или даже десятимиллионных долей секунды, в то время как ощутимый результат ржавления железа можно обнаружить только за время, измеряемое сутками. Многие геохимические процессы, например превращение древесины в уголь, реализуется за промежутки времени, измеряемые миллионами лет. Основные понятия. Система - совокупность веществ, отделенных от внешней среды поверхностью раздела. Если система однородна и не заключает в себе поверхности раздела между частями системы, отличающимися по физико-химическим свойствам, то ее называют гомогенной (гомос- греч. равный). Систему, состоящую из отдельных частей, отличающихся по свойствам и имеющих поверхности раздела называют гетерогенной (гетерос - различный) (рис.2.3).
Состояние системы определяется совокупностью физико-химических свойств, которыми обладает система в данный момент. Если состояние системы в результате самовольно протекающих процессов внутри ее не претерпевает никаких изменений, то система находится в равновесном состоянии. Например, процессы испарения, конденсации, растворения, кристаллизации. Параметры, при которых наблюдается такое состояние называются равновесными. Фаза - совокупность всех однородных по составу и физико-химическим свойствам частей системы. При переходе фаз через поверхность раздела свойства системы изменяются скачкообразно (рис.2.4).
рис. 2.4 Одним из основных понятий в химической кинетике является Скорость химических реакций – изменениеконцентрации реагирующих и образующих веществ за единицу времени, в единице объема для гомогенных реакций и в единице поверхности для гетерогенных.
, где концентрации обозначается [ ] или С и чаще выражается в Естественно, что концентрации исходных веществ (С) уменьшаются, а концентрации продуктов реакции возрастают (рис.2.5).
Двойной знак в этом равенстве зависит от того, о каких концентрациях идет речь: исходных веществах или продуктах реакции. Необходимым условием осуществления химического взаимодействия между двумя молекулами должно быть их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходит тем чаще, чем больше этих молекул. Поэтому скорость химической реакции зависит от концентрации реагирующих веществ. По мере уменьшения концентрации исходных веществ во времени скорость реакции падает (рис.2.5).
Рис. 2.5 Изменение скорости химической реакции В 1865 г. профессор Н.Н.Бекетов впервые высказал гипотезу о количественной взаимосвязи между массами реагентов и временем течения реакции. Эта гипотеза нашла подтверждение в законе действия масс, который был установлен в 1867 г. двумя норвежскими химиками К. М. Гульдбергом и П. Вааге.
|


 , тогда знак и величина DG определяется знаком и величиной DH;
, тогда знак и величина DG определяется знаком и величиной DH;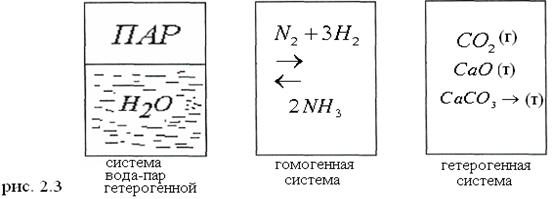




 .
. - концентрация
- концентрация - время
- время




