Классификация дисперсных систем.
Если в какой-либо среде распределено в виде очень мелких частиц другое вещество, то такая система называется дисперсной. При этом в дисперсных системах различают дисперсную фазу – мелкораздробленное вещество и дисперсную среду – однородное вещество, в котором распределена дисперсная фаза. В качестве примера могут быть названы следующие системы: 1. воздух, где мы можем рассматривать азот как дисперсионную среду (его около 78 %), в которой распределены частицы других газов ( 2. туман – мелкие капельки воды, распределённые в дисперсионной среде – воздухе; 3. дым – мелкие частицы твёрдых веществ, распределённые в воздухе. Следующие три типа системы являются наиболее важными. Им соответствуют, например: 4. раствор воздуха в воде; 5. раствор спирта в воде; 6. раствор сахара в воде; 7. раствор водорода в палладии; 8. вода в сливочном масле; 9. синяя каменная соль, цвет которой обусловлен тем, что в NaCl (дисперсионной среде) распределены очень мелкие частицы металлического натрия (дисперсной фазы). Свойства дисперсных систем, в первую очередь их устойчивость, в очень сильной степени зависят от размеров распределённых частиц. В зависимости от размера частиц все дисперсные системы подразделяют на группы: 1. Взвеси (суспензии, эмульсии), у которых частицы имеют размер Например: эмульсия (ж + ж) – молоко, майонез; эмульсия (т + ж) – масло. 2. коллоидные системы, размер частиц Коллоидные частицы состоят из ядра, имеют противоионы и молекулы растворителя. Адсорбированные ионы и противоионы с растворителем образуют адсорбированный слой. Вокруг частиц находится диффузный слой ионов. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
AgJ золь
3. Истинные растворы. Размер частиц дисперсной фазы меньше 1 нм. Например, раствор сахара в воде, раствор солей.
|

 ,
,  и др.);
и др.); м и более.
м и более. м -
м - 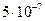 м (1-500 нм).
м (1-500 нм).



