Опыт 5. Определение константы и степени гидролиза солей измерением рН раствора.
Выполнение работы. Определить константу и степень гидролиза хлорида аммония в 0,1 М и 0,001 М растворах и на основании полученных данных сделать вывод об их зависимости от концентрации. (Вместо хлорида аммония можно взять любую соль, подвергающуюся гидролизу.) Получить у лаборанта 0,1 М раствор NН4Сl и определить в нем pH. Затем приготовить 0,001 М раствор NН4Сl. Для этого пипетку на 10 мл ополоснуть полученным у лаборанта 0,1 М раствором, после чего отмерить ею 10 мл этого раствора и внести в колбу вместимостью 1 л. Довести объем раствора до метки на колбе дистиллированной водой, закрыть колбу пробкой и тщательно перемешать раствор, переворачивая колбу несколько раз вверх дном. При отсутствии мерной колбы на 1 л можно приготовить 0,001 М раствор двойным разбавлением: сначала отмеренные 10 мл полученного 0,1 М раствора разбавить в 10 раз в мерной колбе вместимостью 100 мл. Затем пипетку на 10 мл сполоснуть вновь полученным раствором и отмерить с помощью этой пипетки 10 мл и вновь разбавить в другой колбе вместимостью 100 мл. Определить рН приготовленного 0,001 М раствора хлорида аммония тем же методом, каким было сделано первое определение. Записать значения рН, экспериментально найденные в 0,1 М и в 0,001 М растворах хлорида аммония. Вычислить константы гидролиза соли К гидр по найденным значениям рН, исходя из следующих соображений. В соответствии с уравнением гидролиза NН4Сl NН4++ Н2О↔ NН4ОН + Н+ константа гидролиза равна: Из уравнения гидролиза видно, что [NН4ОН] = [Н+]. Вследствие практически полной диссоциации солей в растворе при небольших значениях степени гидролиза равновесная концентрация NН4+–иона мало отличается от начальной, т. е, можно принять, что [NН4+]равн = Ссоли. Тогда получаем расчетную формулу: Ссоли в растворах известна (0,1 М и 0,001 М), а концентрацию Н+-ионов вычислить для каждого случая по найденным экспериментально значениям рН. Степень гидролиза h связана с константой гидролиза соли следующим уравнением: К гидр = Ссоли h2,откуда h= Вычислить по этой формуле степень гидролиза NН4Сl в обоих исследованных растворах. Сравнить экспериментальные значения К гидр и h в 0,1 М и 0,001 М растворах NН4Сl с вычисленными. Сделать вывод о влиянии концентрации соли (разбавлении раствора) на константу и степень гидролиза солей при неизменной температуре. Будет ли изменяться К гидр при повышении температуры? Почему? Контрольные вопросы: 1. В растворе каких солей рН больше 7: 1)Ca(CN)2; 2) Zn(NO3)2; 3) NН4Сl; 4)KCl; 5)Na2CO3 2. Продуктом гидролиза каких солей будут являться основные соли: 1)Na3PO4; 2) К2СО3; 3) ZnCl2; 4) Al2(S04)3; 5) (NH 4)2S04 3. Как можно уменьшить степень гидролиза соли Na2S: 1) повысить температуру; 2) понизить температуру; 3) добавить К0Н; 4) добавить HCl; 5) разбавить раствор?
|



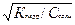 .
.


