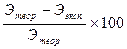Лабораторная работа №1. «Определение эквивалента металла методом вытеснения водорода»
«Определение эквивалента металла методом вытеснения водорода» Цель работы: Экспериментально подтвердить закон эквивалентов. Приборы и реактивы: Прибор для определения эквивалента металла. Аналитические весы и разновесы. Термометр. Барометр. Мензурка на 15-25 мл. Стаканчик химический на 50 мл. Фильтровальная бумага. Образец металла (х.ч.). Соляная кислота 2н. раствор. Наждачная бумага. Часовое стекло.
Для работы можно пользоваться магниевой лентой, порошком восстановленного железа, кусочком алюминия, цинка или другого активного металла. Для получения 30-40 мл водорода следует брать 0,03-0,4 магния или 0,1 г цинка. Прибор для определения эквивалента металла методом вытеснения водорода из кислоты (рис. 1) состоит из колбы 1 (на 25-50 мл), бюретки 3 (на 100 мл) и уравнительного сосуда 4 (на 150-170 мл). Колба 1 соединена с бюреткой 3 тройником. На боковой отросток тройника надета резиновая трубка с зажимом 2 для получения атмосферного давления в приборе при установке мениска. Нижний конец бюретки соединен с уравнительным сосудом резиновой трубкой длиной 30-40 см.
Рис. 1 Прибор для определения грамм-эквивалента металла вытеснением водорода: 1 – колба; 2 - зажим; 3 - бюретка; 4 - уравнительный сосуд
Методика проведения исследования: В колбу 1 внесите 8-10 мл 2н раствора соляной кислоты и укрепите колбу ее горизонтально в штативе. Протерев внутреннюю поверхность горла колбы фильтровальной бумагой, положите в него взвешенный образец металла. Осторожно, чтобы металл не упал в кислоту, закройте колбу пробкой. При открытом зажиме 2 установите с помощью уравнительного сосуда 4 уровень воды в бюретке точно на нулевой метке. Завинтите зажим 2 (см. рис. 1) и испытайте прибор на герметичность, для чего опустите уравнительный сосуд так, чтобы уровень жидкости в нем был ниже, чем в бюретке. Укрепите неподвижно уравнительный сосуд. Если в течение 1-2 мин уровень воды в бюретке будет неподвижен - прибор герметичен. После испытания на прочность, не поднимая вверх уравнительный сосуд, наклоните штатив так, чтобы металл упал в кислоту. Наблюдайте выделение водорода и вытеснение воды в уравнительный сосуд. Через 5 мин, по окончании реакции приведите воду в бюретке и в уравнительном сосуде к одному уровню, т.е. создайте в бюретке давление, равное атмосферному. По положению нижнего мениска воды в бюретке определите и запишите объем выделившегося водорода. Запишите также условия эксперимента: температуру, барометрическое давление. Рассчитайте грамм-эквивалент металла по двум методикам: 1.Применив уравнение состояния идеального газа Клапейрона-Менделеева Поправка на давление водяного пара вводится так как он вместе с водородом вытесняет жидкость в бюретке, поэтому для того, чтобы получить значение давления, производимое только водородом, нужно из атмосферного давления вычесть давление водяных паров при данной температуре На основании закона эквивалентов вычислите грамм-эквивалент металла. R=62400 мл * мм. рт.ст/моль*К По закону эквивалента mH 2. Приведите по уравнению объединенного газового закона Клапейрона объем выделившегося водорода к нормальным условиям (V0Н Замените массу и эквивалент водорода на пропорциональные им объемные значения и получите расчетную формулу. ЭМе = где mMe – навеска металла в граммах V0 H – объем водорода, вытесненного этой навеской (н.у.) Вычислите абсолютную ошибку опыта. Для этого рассчитайте теоретический эквивалент металла, воспользовавшись соотношением его атомного веса с валентностью: Этеор = Абсолютная ошибка = Этеор-Ээксп Вычислите относительную ошибку опыта в процентах: Относительная ошибка =
Таблица 1. Значения давления водяного пара при различных температурах.
Оформление результатов полученных при выполнении лабораторной работы:
Полученные результаты представить в таблице:
Контрольные вопросы. 1. Что называют эквивалентом вещества? 2. Как определить эквивалент кислоты, основания, соли, в кислотно-основных реакциях? 3. Как определить эквивалент вещества в окислительно-восстановительных реакциях? 4. Что такое моль эквивалентов и молярная масса эквивалентов? 5. Рассчитайте молярные массы эквивалента следующих веществ в реакциях обмена: NaOH, H2S, Mg(NO3)2, Ca(OH)2, H2SO4, NH4OH. Составьте уравнения реакций. 6. К раствору, содержащему 1 грамм соляной кислоты, прибавили раствор, содержащий 1 грамм гидроксида натрия. Будет ли полученный раствор нейтральным, кислым, или щелочным?
|


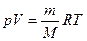 и найдя поправку на давление водяного пара, вычислите массу водорода в измеренном вами объеме.
и найдя поправку на давление водяного пара, вычислите массу водорода в измеренном вами объеме. : mMe= ЭН
: mMe= ЭН 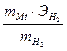

 =
=  . 11200
. 11200