ДНК-лігаза 4 страница
Якщо рівень атрактанту залишається високим, рівень фосфорилювання CheA (а тому і CheY, CheB) буде залишатись низьким, клітина пливтиме рівно і рівень метилювання MCP1 буде збільшуватись, тому що немає CheB-P для деметилювання. Але якщо MCP1 не відповідають на атрактант, коли повністю метильовані. Тому хоча рівень атрактанту може залишатись високим, рівень CheA-P (i Che B-P) збільшується і клітина починає гальмувати. Але зараз MCP1 можуть бути деметильованими CheB-P і коли це відбувається – рецептори можуть знову відповідати на атрактанти. У випадку репелентів ситуація протилежна, тобто повністю метильовані MCP1 відповідають найкраще на репеленти.
13. Особливості експресії генів у еукаріотів і прокаріотів Між експресією генів у еу- і прокаріотів існує багато спільного. Як правило, регуляторну роль виконують білки, хоча є і регуляторні РНК. У прокаріотів процеси транскрипції і трансляції спряжені, тобто можуть відбуватись одночасно. іРНК у прокаріотів часто поліцистронна. Хоча у еукаріотів є репресія, проте вона значно менше розповсюджена, ніж у прокаріотів. У еукаріотів більш поширений позитивний контроль. У еукаріотів не виявлено поліцистронної РНК. У прокаріотів рідко знаходять післятрансляційне розщеплення білків, як у еукаріотів. У еукаріотів, на відміну від прокаріотів, розповсюджений сплайсинг іРНК, тобто її достигання.
14. Антисенсові нуклеїнові кислоти Експресію генів можуть регулювати не лише регуляторні білки, але й регуляторні РНК. Один із типів регуляторних РНК, задіяний в регуляцію кількох генів бактерій, називають антисенсові РНК. Антисенсові РНК діють, утворюючи пари основ з комплементарними, або сенсовими нитками РНК. Коли сенсова РНК є інформаційною, утворюється подвійна структура, що може перешкоджувати трансляції. Антисенсова РНК може синтезуватись з того ж самого гена, що й сенсова. Але вона повинна мати другий промотор, орієнтований в напрямку, протилежному першому, або, маючи другий ген з промотором, на іншому кінці. Антисенсові ДНК можуть також регулювати ініціацію синтезу ДНК як у деяких плазмід. Антисенсові нуклеїнові кислоти можуть також зв’язуватись в ядрі і блокувати транскрипцію. Це можливо завдяки утворенню потрійної спіралі, хоча далеко не всі ДНК здатні до утворення таких комплексів. Антисенсові нуклеїнові кислоти можуть бути синтезовані штучно з метою керування специфічних генів. В цьому випадку вони можуть бути корисними як високоспецифічні антибіотики чи протиракові препарати.
Лекція 7 ЛАКТОЗНИЙ ОПЕРОН E. coli (індукція через зняття репресії лактозою)
1. Загальні положення Кільцева хромосома E. coli містить 4*106 пар нуклеотидів. Цього достатньо для кодування біля 2500 різних білків. Регуляція генетичної активності у прокаріотів практично повністю здійснюється на рівні транскрипції. Оперон – група генів, експресія яких контролюється одним оператором. Регулон – набір оперонів (генів), які контролюються одним і тим самим регуляторним білком (репресором чи активатором). До складу лактозного оперону входять гени, відповідальні за використання дисахариду лактози бактеріями. Цей процес здійснюється ферментами лактазою (β-галактозидазою), галактозидпермеазою (здійснює транспорт лактози через мембрани) та тіогалактозидацетилтрансферазою. Диауксичний ріст – ріст на двох джерелах енергії, одному з яких мікроорганізм надає перевагу, наприклад, у E. coli глюкоза-лактоза.
У даному випадку глюкоза є катаболітним репресором, бо пригнічує експресію генів, відповідальних за метаболізм лактози. 2. Структура лактозного оперону E. coli Ацетилювання β-галактозидів, які не метаболізуються, може бути пов’язане з їх детоксикацією. Мутації lacZ і lacY призводять до нездатності використовувати лактозу як джерело енергії. Мутації lacA не викликають явних порушень росту чи поділу клітин. Без індуктора синтез іРНК з генів lacZ, Y і A відбувається повільно, бо продукт гену lacI – тетрaмерний білок – зв’язаний з оператором lacO і перешкоджає зв’язуванню з промотором lacP РНК-синтетази (виконує роль репресора).
Рис. 7.1. Структура лактозного оперону E. сoli.
lacZ, Y і A експресуються координовано. РНК-синтетаза зв’язується з промотором, але, якщо оператор зайнятий репресором, то внаслідок часткового перекривання ділянок оператора і промотора синтез РНК практично не відбувається.
3. Білок-репресор та механізм його дії У випадку lac -оперону ген, який кодує білок-репресор lacI, знаходиться близько до кластера структурних генів lacZYA. Але це не завжди так. Транскрипція lacI не регулюється. Вона здійснюється з власного промотора з відносно низькою швидкістю і практично не залежить від статусу клітини. Тому спорідненість промотора до РНК-полімерази вважається єдиним регуляторним фактором. Синтезований мономер репресора з 360 амінокислотних залишків утворює тетраметри. Одночасно в одній клітині знаходиться більше 10 тетрaмерів. Репресор має високу спорідненість до специфічної ділянки ДНК, яка лежить між lacP і початком lacZ – це оператор lacO. Оскільки оператор частково перекривається з промотором, то репресор, зв’язуючись з оператором, фізично перешкоджає зв’язуванню РНК-полімерази з промотором і блокує ініціацію транскрипції. Репресор має також велику спорідненість до молекули індуктора лактози. Зв’язування індуктора з репресором викликає алостеричні зміни в молекулі репресора, що істотно знижує спорідненість (в ~1000 разів) репресора до послідовності ділянки оператора ДНК. В результаті репресор дисоціює від оператора і РНК-полімераза може зв’язатись з промотором та почати транскрипцію.
Рис. 7.2. Робота лактозного оперону E. сoli.
4. „Безпричинна” індукція Деякі невеликі молекули слугують індукторами, але самі не метаболізуються β-галактозидазою. Так, однією з таких речовин є ізопропілтіогалактозид (ІПТГ) – один з кількох тіогалактозидів, які зв’язуються з лактозним білком-репресором. Ці речовини зв’язуються з індукторною ділянкою білка-репресора і викликають відповідні конформаційні зміни, але самі не розщеплюються β-галактозидазою. Такий тип індукцій називається безпричинною. В клітині він забезпечує постійну низьку ступінь експресії і речовини, що його забезпечують, не метаболізуються ефекторною групою генів. Це забезпечує синтез певної кількості білків – продуктів lacZYA -кластеру. Через це в клітині завжди присутня певна кількість молекул пермеази. Ймовірно, саме це забезпечує надходження в клітину перших молекул лактози, що викликають індукцію оперону при появі у середовищі лактози.
5. Катаболітна репресія Аналогічно дії глюкози як катаболітного репресора в парі з лактозою, катаболічна репресія знайдена в арабінозному та галактозному оперонах. Катаболітна репресія починається, коли в клітині знижується вміст цАМФ. Вважається, що глюкоза впливає на синтез або деградацію цАМФ. Остання зв’язується з САР-білком (Catabolite Activator Protein) або CRP (cAMP receptor protein). САP – алостеричний регуляторний білок, який зв’язується з САP-ділянкою промотора lac -оперону. Взаємодія САP-білка з цАМФ сильно збільшує спорідненість білка до відповідної ділянки ДНК. Зв’язування САP-білка прискорює зв’язування РНК-полімерази з промотором. Тобто комплекс САP-цАМФ здійснює позитивний контроль транскрипції оперону. Якщо САP-ділянка не зайнята, РНК-полімераза гірше зв’язується з промотором і транскрипція оперону відбувається менш ефективно. Тому, оскільки в присутності глюкози рівень цАМФ знижується, РНК-полімераза повільно транскрибує lac -оперон. І, навпаки, коли мало глюкози, рівень цАМФ зростає, комплекс САP-цАМФ зв’язується з САР-ділянкою. Це, в свою чергу, викликає збільшення транскрипції.
6. Захист ДНК Звернемось знову до контрольних елементів lac- оперону.
Рис. 7.3. Контрольні елементи лактозного оперону.
Для визначення ділянки, з якою зв’язується РНК-полімераза, lac -промотор клонували в бактеріальну ДНК або плазміду. Очищену РНК-полімеразу додавали до вказаної ДНК і після цього обробляли ДНКазою I. Сегмент ДНК, який не деградував під дією нуклеази, виділяли і визначали його нуклеотидну послідовність. Кінці сегменту, який захищається від деградації можуть дещо варіювати, але вказують на місце взаємодії РНК-полімерази з молекулою ДНК. Саме цей спосіб і був використаний для ідентифікації специфічної ділянки зв’язування РНК-полімерази у регуляторній ділянці lac -оперону.
Лекція 8 Молекулярні основи мутагенезу
1. Типи мутацій Мутації – наслідувані зміни генетичного матеріалу. Висока стабільність геному забезпечує постійність ознак, які передаються з покоління в покоління. Проте, постійно і з низькою частотою відбуваються мутації, тобто зміна спадкової інформації, закодованої в ДНК. Якщо вони не летальні, то передаються потомству. Мутації є наслідком дії хімічних чинників та опромінення внаслідок зміни структури деяких основ, розриву фосфодиефірних зв’язків чи порушення організації подвійної спіралі. Можливі мутації і при реплікації чи рекомбінації ДНК.
Іншими джерелами мутацій є вставка довших чи коротших фрагментів ДНК в процесі рекомбінації. Інтеркаляція певних циклічних структур органічних речовин також може вести до вставки нуклеотидів. Мутації можуть проявлятися і не проявлятись фенотипово. Мутації поділяють на 2 типи: заміну основ і зсув рамки. Заміна основи включає транзиції – заміну однієї пари пурин-піримідин іншою, та трансверсії – заміну пари пурин-піримідин парою піримідин-пурин. Зсув рамки зчитування є більш радикальною мутацією ніж заміна основи. В результаті або випадають, або вставляються одна чи багато пар основ.
Точкові мутації Ці мутації в зоні ДНК, яка кодує білок, майже завжди викликають зміну амінокислотної послідовності відповідної ДНК.
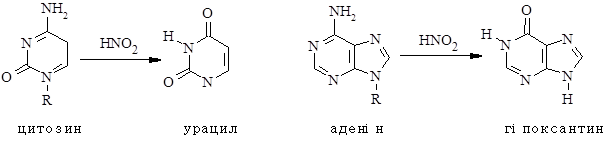
„Помилка” в ДНК транскрибується в РНК і ця змінена РНК слугує матрицею для синтезу білка. Оскільки транскрибується лише одна нитка ДНК, то АТ-пара не рівноцінна ТА-парі. Генетичний код вироджений, тобто в деяких випадках одну амінокислоту кодує більше одного триплету, тому не всі мутації проявляються у зміні структури білка. Рисунок демонструє можливі мутації одного тирозинового кодону. Як видно, зміна РНК з UAС на UAU не призводять до заміни амінокислоти. Такого типу мутації називаються „мовчазними”, тобто кодовані області майже завжди відбуваються в третій основі кодону. Проте аргінін та лейцин можуть мати „мовчазні” мутації також у першій позиції. Заміна першої чи другої основи часто веде до істотних змін білка. Наприклад, одинична заміна UAC на AAC викликає заміну в білку залишку тирозину на аспарагін. Цей тип мутацій отримав назву міссенс-мутації (sense – sequence of amino acids). Кодований поліпептид змінений. Якщо зміна відбувається в критичнім місці поліпептидного ланцюга, то білок може бути або зовсім неактивним, або зі зниженою (збільшеною) активністю. Ще одна можливість – утворення стоп-кодону. В результаті відбудеться передчасна зупинка синтезу білка, який, швидше всього, буде нефункціонуючим. Ці мутації називають нонсенс-мутаціями. Вони змінюють кодон амінокислоти (sense codon) на стоп-кодон (nonsense codon). Не всі мутації із заміною амінокислот ведуть до утворення нефункціональних білків. Результат залежить від того, в якому місці поліпептиду і яка саме заміна відбулась, як це впливає на вкладання білкової молекули, її каталітичні властивості. Міссенс-мутації можуть призвести до змін, які модифікують чутливість білка до підвищеної температури. Такого типу мутації називають температурно-чутливими. Наприклад, температурно-чутливі мутанти бактерій живуть нормально при 30 0С, але не можуть рости при 400С, хоча „дикий” тип росте при двох температурах. Такі мутації часто називають умовно летальними, оскільки бактерії не можуть рости за одних умов і ростуть за інших. Чутливі до температури фенотипи часто утворюються тому, що мутантний білок може мати коректну укладку структури при низьких температурах, але частково змінену (денатуровану) при високій температурі. Окрім вставки та делеції однієї пари нуклеотидів можливі аналогічні зміни з багатьма парами. Великі делеції чи вставки відбуваються при генетичній рекомбінації. Вставки можуть інактивувати ген, якщо вони розривають його. Багато мутантів в результаті вставки утворюються через перенесення специфічних послідовностей ДНК довжиною 700-1400 пар. Вони називаються вставними послідовностями – типом транспозонних елементів. Інший тип великих мутацій пов’язаний з реорганізацією в результаті помилок в рекомбінації. Вони включають транслокації та інверсії. При транслокаціях великі фрагменти хромосом переміщуються в нові місця (у еукаріотів інколи на інші хромосоми). При інверсіях певні фрагменти ДНК змінюють орієнтацію відповідно до оточуючої ДНК. Все це говорить про так звані прямі мутації. Є ще так звані зворотні мутації. Точкові мутації можуть бути оберненими. Найчастіше в такому випадку мова йде про бактерії. Відновлені мутанти мають фенотип диких, який був утрачений у мутантах. Їх іменують ревертантами. Розрізняють два типи ревертантів з реверсіями по тому ж самому місці і по іншому. В першому випадку мутація, що відновлює активність, відбувається в тому ж самому місці, що і вихідна мутація. У другому випадку мутація відбувається в іншому місці ДНК. У випадку реверсії на іншому місці можливе відновлення фенотипу „дикого типу” в результаті кількох типів супресорних мутацій, які відновлюють вихідний фенотип. Супресорні мутації – це нові мутації, які компенсують ефект вихідної мутації. Відомо кілька типів супресорних мутацій: 1. Мутації в іншому місці того ж гену, які відновлюють функцію ферменту, наприклад, мутації зсуву рамки зчитування. 2. Мутації в іншому гені, які можуть відновити фенотип „дикого” типу. 3. Мутації можуть призводити до утворення іншого ферменту, який може замістити мутантний фермент введенням метаболічного шляху, відмінного від того, що використовувався немутантним ферментом. В останньому випадку вихідний фермент не утворюється, хоча це відбувається в перших двох випадках. Мутації РНК. РНК-віруси Швидкість мутуванння РНК-геномів ~1000 разів вища, ніж ДНК. Цьому є кілька причин: 1. РНК-реплікази не мають репаразної активності подібно до ДНК-полімераз. 2. Існує багато ДНК-репаразних механізмів, чого не знайдено для РНК. Це пов’язано, можливо, з тим, що, як правило, ДНК має двоспіральну організацію, а РНК – односпіральну. Інтерес до мутування РНК окрім академічного інтересу, має прикладний, адже багато вірусів є збудниками хвороб, а зміна геному створює додаткові проблеми в їх лікуванні та профілактиці. 2. Хімічна модифікація основ Основи в ДНК чутливі до дії багатьох хімічних речовин, включаючи азотисту кислоту (НNO2), гідроксиламін (NH2OH) і різні алкілюючі агенти – диметилсульфат і N-метил-N8-нітро-N-нітрозогуанідин.
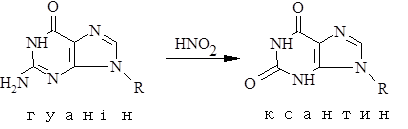
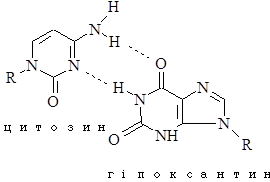
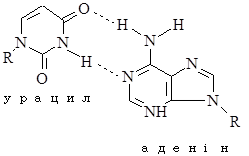
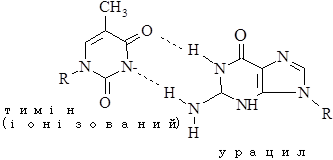
Перетворення гуанідину на ксантин під дією азотистої кислоти не змінює властивостей утворювати водневі зв’язки. Нова основа спарюється з цитозином – нормальним партнером гуаніну. Проте перетворення АàHpx або СàU змінює нормальне утворення водневих зв’язків у подвійній спіралі.
При наступній реплікації відбувається заміна відповідних основ і закріплення заміни.
Алкілюючі агенти можуть змінювати структуру азотистих основ, руйнувати фосфодиефірні зв’язки і фрагментувати ланцюги ДНК. Окрім того деякі алкілюючі агенти можуть взаємодіяти ковалентно з двома ланцюгами, утворюючи мостики.
Активовані форми кисню (O2-, H2O2, OH·), які утворюються як побічні продукти нормальних клітинних процесів, також викликають спонтанні зміни ДНК. Спонтанне дезамінування цитозину в ДНК людини відбувається з частотою біля 100 пар основ на геном за день, а депуринізація – в 50 разів частіше.
3. Радіаційне пошкодження. Ультрафіолетове світло, включаючи сонячне, рентгенівські промені поглинаються молекулами ДНК і в залежності від енергії можуть викликати різного типу зміни – від розриву ланцюгів до утворення іонізованих форм азотистих основ. Іонізовані основи не можуть спарюватись з нормальними партнерами. Це істотно збільшує частоту мутацій синтезованої молекули ДНК.
УФ-промені поглинаються азотистими основами, що викликає утворення димерів між розташованими близько піримідиновими основами. Активація етиленових зв’язків цих основ часто призводить до фотохімічної димеризації – утворення Т-Т-зшивок.
Найчастіше таке перетворення відбувається з тимінами. Рідше можливе утворення димерів цитозину, або тиміну з цитозином. Високоенергетична радіація (рентгенівські промені, γ-промені) можуть розривати фосфодиефірні зв’язки, циклічні структури тощо. Радіація в присутності кисню зумовлює утворення великої кількості окислених продуктів.
4. Помилки ДНК-полімерази З певною частотою ДНК-полімераза приєднує некоректні нуклеотиди. Проте, вони коректуються репаразною активністю ДНК-полімерази. Система корекції невірно вставлених нуклетидів відслідковує порядок по материнській молекулі ДНК, виявляє невірне спарювання. Така корекція здійснюється мультиферментним комплексом, який вирізає невірно вставлені нуклеотиди тільки із нової синтезованої молекули. В молекулі ДНК є спеціальні послідовності GATC, в яких А етилюється, але не зразу, а згодом. Тому комплекс диференціює дві різні молекули ДНК. ДНК-полімераза нездатна відрізнити нормальні та близькі за структурою дезоксирибонуклеозидтрифосфати. Це також може бути причиною мутацій. Прикладами такого механізму є використання 5-бромурацилу та 2-амінопурину для експериментального мутагенезу. Пара 5-бромурацил-А замінюється на GC-пару з заміною АТ на GC. Нормально система репараз виправляє пошкодження ДНК. Проте, в деяких випадках репараційна система сама вводить мутації. Часто пошкодження ДНК індукують системи репарації. Описаний складний клітинний механізм, названий SOS-регуляторною системою. Вона активується в результаті пошкодження ДНК, ініціюючи багато процесів репарації ДНК. Проте, в системі SOS деякі процеси репарації відбуваються за відсутності матриці. Це призводить до появи багатьох помилок. У випадку SOS-системи пошкодження ДНК слугує стресовим сигналом, викликаючи дерегресію (індукцію) чисельних клітинних функцій, включаючи репарацію ДНК. Зазвичай, SOS-система репресована білком LexA.
5. Розтягування подвійної спіралі Певні хімічні сполуки з ароматичними кільцями і відповідними розмірами та геометрією можуть бути вмонтованими між парами основ у подвійній спіралі ДНК. Цей процес називається інтеркаляцією. При інтеркаляції сусідні пари основ розділюються Це дозволяє стати між ними молекулі інтеркалятора і викликає витягування подвійної спіралі. Такі зміни руйнують неперервність послідовності ДНК і перешкоджають зчитуванню з матриці ДНК-полімеразою. В результаті утворюється дочірня молекула ДНК з додатково вбудованими основами. Такого типу мутації іменуються зсувом рамки. Інтеркаляторами є акридини, атиділбромід тощо. Ці речовини є досить ефективними мутагенами.
6. Біологічний мутагенез. Мутації можна ввести без використання хімічних чи фізичних чинників. Їх можна викликати так званим транспозонним мутагенезом. Суть його полягає в тому, що якщо всередину гену вставити рухливий генетичний елемент (транспозон), то в результаті розриву гену, останній втрачає функціональну активність. Наприклад, бактеріофаг Mu може слугувати мутагеном, розриваючи в ДНК послідовності, які кодують певні білки. Оскільки рухливі елементи можуть вмонтуватись в будь-якому місці ДНК, то вони широко використовуються для мутагенезу в бактеріях. 7. Спрямований мутагенез (site - directed) Технологія рекомбінантної ДНК і використання синтетичної ДНК дозволили викликати специфічні мутації специфічних генів. Процедура проведення мутагенезу в специфічних місцях геному отримала назву спрямованого мутагенезу (site-directed mutagenese). Суть методу полягає в наступному. Отримують специфічний ген-ділянку ДНК і визначають його нуклеотидну послідовність. Визначають місця, які кодують початок і кінець синтезу пептиду. На основі цього проводять заміну конкретних основ. Далі змінену ДНК вводять в клітину-реципієнт і бактерії скринінгують за певною ознакою для виявлення мутанту. Ці мутанти будуть відрізнятись від вихідних організмів однією (чи кількома) чітко визначеними наперед замінами. Цілеспрямований мутагенез широко використовується в генетиці мікроорганізмів і молекулярній біології, а також для структурно-функціональних досліджень ферментів та інших білків.
|