ДНК-лігаза 2 страница
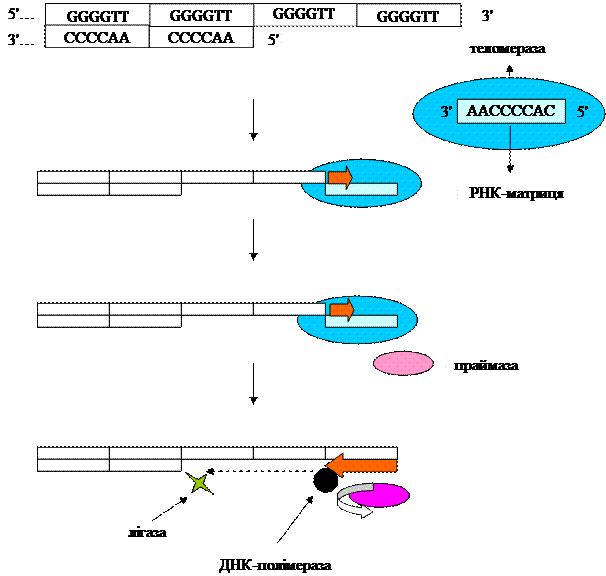
кількох частково реплікованих молекул ДНК у дуже великі молекули, із яких необхідні копії відрізаються спеціальними ендонуклеазами. Теломери і теломерази Для реплікації кінців молекули ДНК використовуються так звані теломери. Один з нечастих підходів і полягає в подовженні кінців хромосоми транспозонами – фрагментами ДНК, що рухаються по геному. Такий механізм виявлено у плодової мушки Drosophila. Для реалізації даного механізму необхідний фермент зворотна транскриптаза, або теломераза. Активність теломерази залежить від наявності молекули РНК, яка входить до структури теломерази і слугує внутрішньою матрицею. Збереження довжини хромосоми під дією теломерази залежить від повторюваних послідовностей ДНК, які складають теломери хромосом еукаріотів. Теломераза розпізнає багаті гуанозином ділянки одноланцюгових ДНК на 3´-кінці і продовжує їх в напрямку 5´à3´, додаючи теломерні повтори на кінці відстаючого ланцюга. РНК-теломерази довжиною біля 150 нуклеотидів комплементарних до теломерних повторів, забезпечує рухому матрицю, яка заміщує нормальну матрицю ДНК. Теломераза забезпечує одночасно і матрицю, необхідну для елонгації ланцюга на 3´-кінці, і має необхідну для такої елонгації ферментативну активність. Збереження довжини хромосоми залежить від таких факторів як процесивність теломерази, частота її дії на теломери, а також швидкості деградації теломерної ДНК. Теломери можуть рости, зменшуватись, або залишатись досить постійними залежно від генетичних змін чи живлення. Наприклад, розмір теломерів дріжджів може змінюватись від 200 до 400 пар основ у залежності від умов. Кінці хромосом еукаріотів – теломери. Теломери містять повтори ДНК – короткі послідовності (частіше всього 6 пар основ), які тандемно повторюються від 20 до кількох сотень разів.
Рис. 3.14. Участь теломерази в нарощуванні теломерних ділянок. Лекція 4 РЕПАРАЦІЯ ДНК
1. Загальні положення ДНК є єдиною молекулою, яка при пошкодженні переважно репарується, а не деградує. Репарація дуже ефективна – краще ніж одна на 1000 випадкових пошкоджень ДНК. Решта коригується іншими процесами. Швидкість мутування виявляли двома незалежними підходами: за частотою появи мутантів у популяціях (на прикладі популяцій плодової мушки), або за частотою появи специфічних білків (в клітинах культури тканин). Було виявлено, що за одне покоління мутує одна пара основ на 109 пар. На основі цього розрахували, що для середнього білка, який кодується 1000 парами основ, мутація має відбутись один раз на 106 генерацій клітини. Статеві клітини захищаються від мутацій для збереження виду, а соматичні, щоб уникнути хвороб та неконтрольованого росту. Виявлено два типи репарацій: перший, але дуже мало поширений – пряме обернене пошкодження; другий – широко поширений механізм – заміщення пошкодженої ділянки ДНК. Останній залежить від наявності двох комплементарних ланцюгів ДНК. Він забезпечує постреплікаційну репарацію рідких зшивок та постреплікаційну SOS-репарацію. При такій репарації корекція відбувається з використанням непошкодженої нитки ДНК як матриці. Ферменти, які беруть участь у репарації ДНК, беруть також участь і в рекомбінації і, частково, в транскрипції. Метаболізм ДНК інтегрує важливі процеси, які координуються через використання одних і тих самих молекулярних інструментів для вирішення різних завдань.
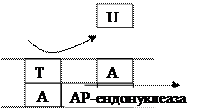
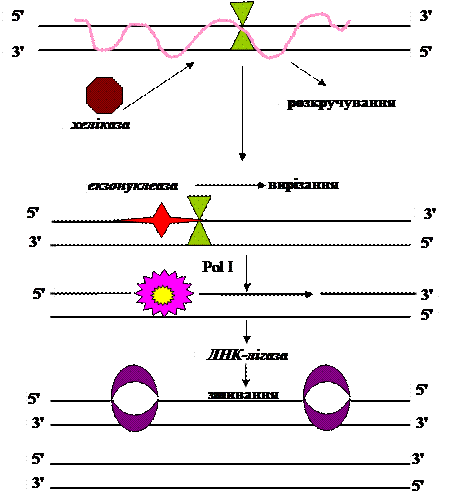
2. Репарація вирізанням у E. coli Цей механізм, забезпечує репарацію специфічних пошкоджень ДНК, універсальний і виявлений в усіх досліджених організмах. Він характеризується чотирма послідовними етапами: надрізання, вирізання, ресинтезу і з’єднання. Надрізання – етап розпізнавання і є індивідуалізованим для специфічного пошкодження. Цей момент контролює швидкість усього процесу репарації. В результаті вирізання на молекулі ДНК утворюється вільний проміжок. Проміжок заповнюється ДНК-полімеразою I. Фосфоефірний зв’язок після синтезу коректної ділянки замикає ДНК-лігаза. Репарація вирізанням основи Дезаміновані, метильовані чи модифіковані іншим шляхом азотисті основи гідролітично видаляються ДНК-глікозилазами з утворенням апуринової чи апіримідинової ділянки (АР) ДНК. Аналогічний гідроліз може відбуватись і спонтанно. Далі специфічна до АР-ділянок ендонуклеаза вирізає залишок пошкодженого нуклеотиду.
Рис. 4.1. Репарація вирізанням основи у E. сoli. Репарація вирізанням нуклеотиду Цей тип репарації функціонує, коли утворюються „об’ємні” адукти. Наприклад, в результаті взаємодії поліциклічних ароматичних вуглеводів, таких як бензо[а]пірени і диамінбензантрацени, генеровані курінням, тимінпсораленові адукти і гуанінцисплатинові адукти, утворені хеміотерапевтичними засобами. Ультрафіолетове світло також каталізує утворення об’ємних адуктів в результаті димеризації піримідинів. При утворенні зшивки ендонуклеаза розрізає модифікований ланцюг з обох сторін і вирізає їх. UvrА – розпізнає і „мітить” пошкоджену ділянку. Дана нуклеаза розпізнає спіраль і зв’язує UvrB, викликаючи перед цим конформаційні зміни UvrB. Далі UvrА дисоціює від комплексу ДНК-UvrB, що робить можливим з’єднання з ним UvrС. UvrB розрізає пошкоджений ланцюг з 3´-кінця, а UvrС розпізнає його з 5´-кінця. Геліказа II (UvrD) звільнює вирізаний олігонуклеотид, а ДНК-полімераза заміщує UvrВ і заповнює звільнений проміжок. Останні кроки в цього типу репарації полягають в з’єднанні синтезованої ділянки з рештою ланцюга ДНК-лігазою.
3. Репарація вирізанням у еукаріотів Цей тип репарації дуже подібний у про- і еукаріотів. Проте в останніх в цьому бере участь значно більша кількість білків ~16-17. У E. coli їх небагато – всього чотири: UvrA, B, C і D. Так білки XPA, В, XPG ідентифіковані як 7 генетичних елементів групи (A-G) у пацієнтів з інтенсивною пігментацією шкіри (серодерми (Хeroderma Рigmentifolium – XP). Характеризуються підвищеною чутливістю до УФ-опромінення з відповідною недостатністю в репарації ДНК. Гени репарації нуклеотидів людей тому називають ХР, або ERC (Excision Repair Component). Через репарацію вирізанням вирізаються зшивки між комплементарними нитками ДНК, викликаними гірчицею і лікарствами, що використовуються в терапії ракових захворювань (такими як мітоцин D і платинові комплекси). Даний тип репарації функціонує практично без помилок, бо в якості матриці для репарації пошкодженого ланцюга ДНК використовується другий непошкоджений ланцюг. Проте такого роду репарація неможлива, коли утворюються поперечні зшивки між основами з двох різних ланцюгів ДНК.
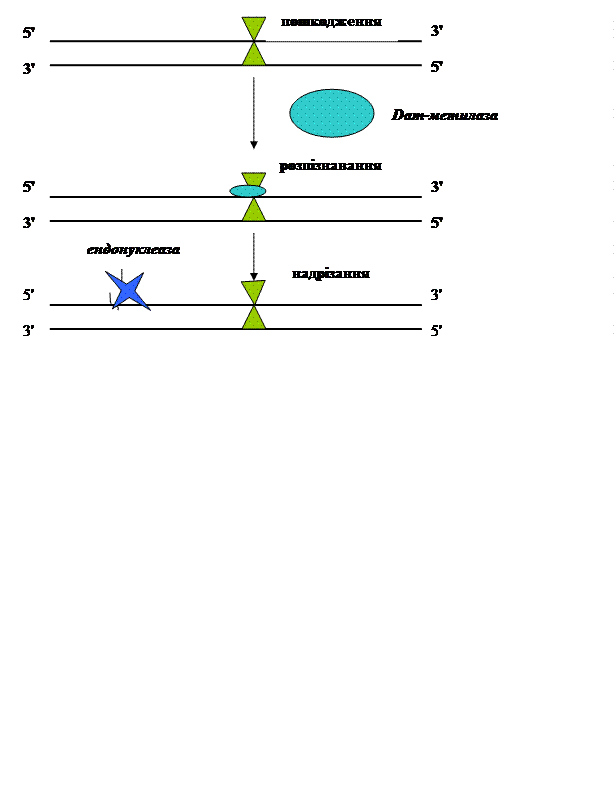
4. Репарація при реплікації Цей механізм функціонує для корекції помилок, які виникають в ході реплікації – як у про- так і в еукаріотів. Суть його полягає в ідентифікації нуклеотиду, помилково приєднаного до ланцюга, його вирізанні та в з’єднанні коректно синтезованого олігонуклеотиду з рештою молекули ДНК. Даний механізм дуже істотно зменшує кількість помилок синтезу ДНК – більш, як в 1000 разів. Особливість даного типу помилок полягає в тому, що хоча основи й некоректні, але вони мають незмінну хімічну структуру, тому необхідно розрізняти старий і новий ланцюги ДНК. Сигналом для розпізнавання у E. coli є метилювання ДНК ферментом Dam-метилазою. В послідовності GATC він метилює аденін в положенні N-6. Зразу після реплікації новий ланцюг не метильований, а цей процес відбувається відносно повільно. Тому ферменти репарації по наявності метильованих груп у аденіні згаданої вище послідовності розпізнають лише материнську, а не дочірню молекулу ДНК.
Рисунок
Рис. 4.2. Репарація при реплікації у E. сoli.
Ініціація починається зі зв’язування білка MutS до некоректного місця. До нього приєднується білок MutL. Комплекс MutS-MutL активує латентну GATC-ендонуклеазну активність білка MutH. Саме він надрізає неметильований ланцюг ДНК (тобто – дочірній) біля ділянки GATC. В результаті вирізається ділянка в кількасот нуклеотидів від 3´-кінця некоректного ланцюга. Синтез потребує участі ДНК-гелікази II (деколи її називають MutU), 3´à5´-екзонуклеази, ДНК-полімерази III і, накінець, ДНК-лігази – для з’єднання репарованої нитки з рештою молекули ДНК. Дуже подібний механізм корекції помилок, що виникають при реплікації, існує і в еукаріотів.
5.Відновлення пошкоджень Утворення димерів може бути спричинене дією світла. Фотовідновлення каталізується фотоліазою дезоксирибопіримідинів. Вони розривають ковалентні зв’язки, які утримують разом молекули пиримідинів у димері. Фотоліази активуються світлом в області 300-600 нм. Ці ферменти виявлені у бактерій і не є абсолютно необхідними для них. В людини ферментів цього типу не виявили. Видалення метильних чи етильних груп з 6-го положення фенольної форми гуанідину відновлює його нормальну структуру. Спеціальний білок „забирає” відповідну групу і, таким чином, сам стає алкільованим. Надалі від деградує.
Лекція 5 Транскрипція 1. Загальні положення 2. Ініціація та власне транскрипція 3. Термінація 4. РНК-полімерази про і еукаріот та архебактерій 5. Процесинг РНК 6. Рибозими
1. Загальні положення Всі типи РНК матрична (інформаційна), транспортна, рибосомальна і мала – утворюються в процесі транскрипції. При її синтезі у якості матриці використовується, як правило, молекула ДНК. Є три принципові різниці між ДНК і РНК: А. У РНК в якості вуглеводу виступає рибоза, а не дезоксирибоза, як в ДНК. Б. РНК містить урацил замість тиміну. В. За виключенням деяких вірусів, РНК одноланцюгова. Такі зміни хімічного складу і будови змінюють хімічні властивості НК. Тому ферменти, які діють на РНК, не діють на ДНК і навпаки. Заміна тиміну на урацил не змінює здатності спарюватись з аденіном. ДНК виконує тільки генетичну роль – тобто несе генетичну інформацію. РНК переносить її від ДНК, а також є безпосереднім носієм генетичної інформації у деяких вірусів. Проте РНК виконує безпосередньо ще й функціональну роль. Так, вона є структурним і функціональним елементом рибосом, переносником амінокислот (тРНК). Деякі типи РНК мають каталітичну (ферментативну) активність і є регуляторами експресії генів. Транскрипція РНК з ДНК забезпечується ферментом ДНК-залежною РНК-полімеразою. Тобто фермент синтезує РНК, використовуючи нуклеотидтрифосфати, але тільки в присутності матриці ДНК. Хімізм синтезу РНК в цілому подібний до синтезу ДНК. Так, в процесі елонгації ланцюга РНК-нуклеотиди додаються до 3´-ОН-групи рибози попереднього нуклеотиду – два макроергічні зв’язки. Як звідси зрозуміло – синтез іде в напрямку 5´à3´, а природно, напрям матриці протилежний. На відміну від ДНК-полімерази, РНК-полімераза може почати синтез РНК без затравки. При цьому на 5´-кінці залишаються три залишки фосфату. Першими основами в молекулі РНК майже завжди є пурини – аденін чи гуанін. Матрицею для РНК-полімерази практично завжди є ДНК, але лишень один її ланцюг.
Рис. 5.1. Транскрипція РНК.
РНК-полімераза зв’язується з промотором. Напрям транскрипції визначається орієнтацією послідовності промотора. РНК-полімераза рухається від промотора, синтезуючи молекулу РНК. Полімераза рухається, розплітаючи короткі фрагменти ДНК, транскрибуючи їх. Зразу ж за нею подвійна спіраль відновлюється. В результаті тимчасового розплітання азотисті основи нитки матриці відкриваються і можуть бути скопійовані комплементарно в РНК. Слід ще раз підкреслити – місце початку і напрям руху полімерази визначає промотор і його орієнтація. Закінчується транскрипція в місцях локалізації так званих термінаторів транскрипції. Це принципово відмінно від реплікації, при якій копіюється весь геном. Тому транскрипція дозволяє синтезувати РНК з різних ділянок і з різною частотою, що залежить від потреб клітини.
2. Ініціація і власне транскрипція Промотори відіграють ключову роль в ініціації синтезу РНК. Промоторами є специфічні послідовності на молекулі ДНК з якими з’єднується РНК-полімераза. Послідовність багатьох промоторів із різних джерел на даний час встановлена.
Рис 5.2. Структура РНК-полімерази. Промотори розпізнаються σ-фактором РНК-полімерази. Багато промоторних послідовностей можуть розпізнаватись одним тим самим σ-фактором. На рисунку приведений один із промоторів E. coli. Активними в промотора є дві ділянки і саме вони розпізнаються σ-фактором. Одна із них – знаходиться за 10 основ від початку транскрипції, тому вона називається – 10 (Pribnow box). Висококонсервативні ділянки ДНК, які відповідають за зв’язування з σ-фактором, називають консенсусними. У даному випадку для Прібнов-бокса – це ТАТААТ. Друга консенсусна ділянка знаходиться за ~35 пар від місця початку транскрипції. В нашому прикладі консенсусна послідовність ~35 містить ТТGАСА. Консенсусні послідовності визначаються шляхом порівняння послідовностей багатьох промоторів. На рисунку дана послідовність лишень одного ланцюга. Між генетиками прийнято, що показаний ланцюг орієнтований своїм 5´-кінцем догори. Тому це не ланцюг, використовуваний в якості матриці РНК-полімеразою. Вказування послідовності лишень одного ланцюга економить місце і час при написанні. Але слід пам’ятати, що промотор – це ділянка ДНК і вона є дволанцюговою. Корова частина (серцевина) РНК-полімерази взаємодіє з σ-фактором. Останній розпізнає промоторну ділянку і взаємодіє з ДНК. В результаті утворення комплексу РНК-полімерази з промотором і за наявності нуклеотидтрифосфатів здійснюється синтез РНК. Після того, як синтезувався фрагмент РНК, σ-фактор дисоціює і коровий фермент продовжує полімеризацію. Отже, σ-фактор необхідний лишень для розпізнавання ділянки промотора ініціації транскрипції. Слід зазначити, що саме σ-фактор відповідальний за експресію тих чи інших генів. В клітині, як правило, є кілька типів σ-факторів і саме через їх відносний вміст регулюється переважно експресія тих чи інших генів. Вміст же σ-факторів у свою чергу регулюється багатьма чинниками як зовнішніми, так і внутрішніми.
3. Термінація Термінація відбувається завдяки наявності на молекулі ДНК спеціальних термінальних послідовностей. Вони містять так звані інвертовані повтори з центральною неповторюваною ділянкою. Утворення стебла і петлі РНК зразу ж вниз від приєднання урацилів призводить до закінчення транскрипції. Транскрибування інвертованого повтору і уридинової послідовності, дозволяє утворення подвійної структури (стебла) і петлі. Саме утворення даної структури і є сигналом для закінчення транскрипції.
Рис. 5.3. Утворення петлі термінації трансляції. Іншою ділянкою термінації є області багаті GC-послідовностями, за якими слідують AT-багаті ділянки. Такі структури призводять до термінації без додаткових факторів. Іноді їх називають „внутрішніми термінаторами”. Ще один тип термінації передбачає участь спеціального білкового фактора. У E. coli роль такого фактора виконує білок Rho. Він не зв’язується ні з РНК-полімеразою, ні з ДНК, але міцно зв’язується з РНК і рухається вниз, вздовж РНК-полімераза-ДНК-комплексу. При проходженні Rho -залежної ділянки термінації Rho викликає дисоціацію РНК і полімерази від ДНК. Це викликає термінацію транскрипції. Інші білки, які задіяні в термінацію транскрипції, діють аналогічно Rho. У всіх випадках послідовність, задіяна в термінацію, діє на рівні РНК. Проте, слід пам’ятати, що РНК синтезується на ДНК як на матриці. Отже місця термінації визначаються специфічною послідовністю нуклеотидів ДНК.
4. РНК-полімерази Істотно відрізняються у про-, еукаріотів та архебактерій. Найкраще вивчений фермент E. coli. Він складається з 4 різних типів субодиниць α, β, β´ і σ. Є дві копії α-субодиниці. Всі субодиниці, за виключенням σ-субодиниці, взаємодіють досить сильно. Вони утворюють так званий коровий (серцевинний) фермент РНК-полімеразу. Коровий фермент може сам каталізувати утворення РНК. Роль σ-фактора полягає в розпізнаванні специфічної ділянки ДНК, для ініціації синтезу. РНК-полімераза – великий фермент і утворює контакти з багатьма основами ДНК одночасно. Вона взаємодіє з великою боріздкою ДНК. Знову ж для початку реплікації РНК-полімераза спочатку повинна коректно ідентифікувати місце зв’язування на ДНК – тобто – промотор. РНК-полімераза еукаріот Відомо 3 типи РНК-полімерази еукаріотів. Кожен з них відповідає за синтез специфічної РНК. Всі вони досить складні і містять багато типів рРНК. РНК-полімераза II синтезує всі іРНК. РНК-полімераза III синтезує тРНК і один тип рРНК. Кожен з цих типів розпізнає лишень свій тип промоторів. У бактерій промотор, який обслуговує ген, що кодує білок, може бути дуже подібний на промотор гену, що кодує тРНК. У еукаріотів такого не буває. РНК-полімераза специфічно взаємодіє з промотором, але ця взаємодія значно складніша, ніж у бактерій. В ній задіяно багато інших білків.
Рис. 5.4. Ініціація трансляції у еукаріот. Полімераза має повторні послідовності на одному кінці, які можуть бути фосфорильовані. Решта з багатьох білків також задіяні в ініціацію Приведений тут промотор містить ТАТА-бокс – дуже консервативний, щось на зразок Прібнов-бокса у бактерій. Він знаходиться біля місця початку транскрипції. Одна або дві такі послідовності, зазвичай, розпізнаються полімеразою II. Не виключено, що термінація транскрипції каталізована полімеразою II відбувається подібно в усіх генах.
РНК-полімераза архебактерій Архебактерії подібно до бактерій мають одну РНК-полімеразу, але вона більш подібна на полімеразу еукаріот, ніж бактерій. Більшість промоторних послідовностей архебактерій містить консервативні АТ-послідовності з 6-8 пар основ біля 18-27 пар вище місця початку транскрипції. Дана послідовність нагадує Прібнов-бокс бактерій, але більш подібна з послідовністю і за місцезнаходженням до ТАТА-бокса промоторної ділянки РНК-полімерази II. ЇЇ називають ТАТА-послідовністю. Термінація в деяких випадках в місцях інвертованих повторів за якими слідують багаті АТ-ділянки.
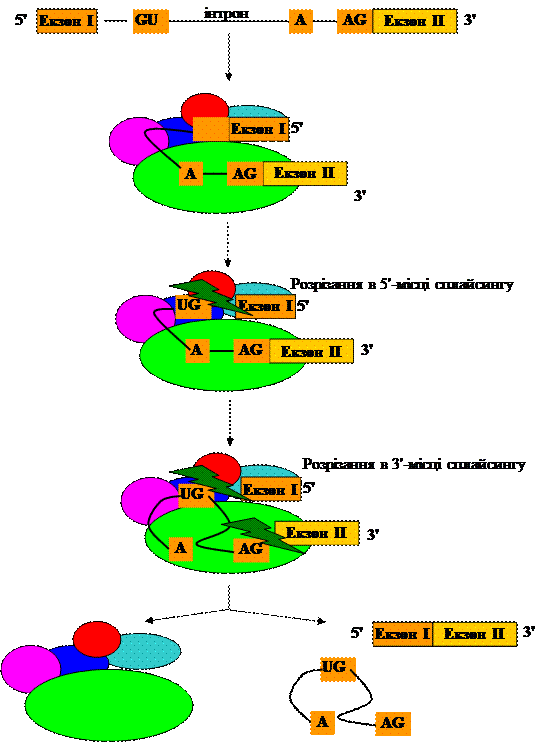
5. Процесинг РНК У прокаріотів кодуючі білок транскрипти копіюються у відповідну іРНК з якої безпосередньо синтезується білок. Проте, транскрипти інших типів генів повинні пройти процес „достигання” – процесинг. У еукаріотів усі транскрипти повинні достигати перш, ніж бути використаними. Перетворення попередника РНК в зрілу молекулу РНК називається процесингом – достиганням. У про- і еукаріотів тРНК і рРНК спочатку синтезуються як довгі молекули попередників. Після цього вони „достигають”. В еукаріотів, гени яких містять послідовності, що не кодують амінокислоти – інтрони, чергуються з екзонами. Ці області несуть інформацію про послідовність амінокислот. Первинний транскрипт із такого гену має бути істотно модифікований, перш ніж його можна буде використати для синтезу білка. Тільки в кількох випадках інтрони, виявлені в ДНК, яка кодує білок у бактерій та бактеріофагів. Процес, в ході якого видаляються інтрони, а екзони з’єднуються, називають сплайсингом (splicing – скріплення, зрощування).
Рис. 5.5. Процесинг РНК еукаріот.
Еукаріоти мають унікальний механізм для видалення інтронів з пре-іРНК. В процесі беруть участь кілька типів рибонуклопротеїдів, які називають сплайсмосомами. Вони містять малу РНК і кілька білків. Інтрони вирізаються і деградують. Проте, останнім часом накопичуються дані, що інтрони можуть виконувати певні функції. Вирізання деяких інтронів тРНК і генів у мітохондріях і хлоропластах здійснюють білки. Кілька інтронів, включаючи деякі знайдені в бактеріях та бактеріофагах вирізаються самостійно, тобто вони є рибозимами. РНК еукаріотів піддається при достиганні ще двом процедурам – ще до виходу з ядра. Перший крок – так зване кепіювання (cap - шапка). Кепіювання здійснюється ще до закінчення транскрипції. Суть його полягає в тому, що до 5´-кінця додається метильований гуанідин, який називається кепом. Після транскрипції багато основ у іРНК метилюються. Окрім того 2´-гідроксильні групи рибози також можуть метилюватись. На 3´-кінці іРНК при достиганні приєднуються полі-А хвіст (tail). Цей процес може проходити паралельно з термінацією. Всі ці три етапи призводять до утворення зрілої іРНК еукаріотів.
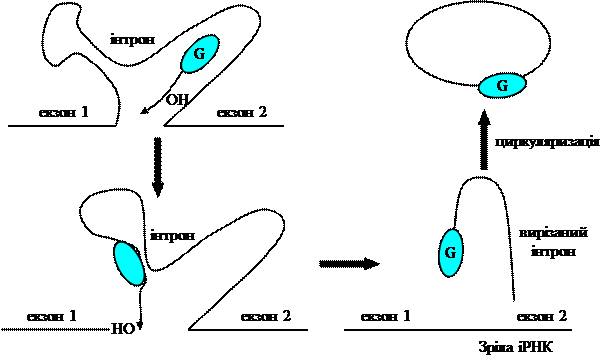
6. Рибозими Раніше вважалось, що роль РНК у нуклеопротеїдних комплексах, наприклад, рибосомах структурна. Каталітичні функції здійснюються білками. Теломераза дала інший приклад – тут РНК використовується як матриця. Проте, було встановлено, що певні типи РНК можуть діяти як каталізатори. Каталітичні РНК, які називають рибозимами, задіяні в багато клітинних процесів. Такі біокаталізатори діють як класичні білки – ферменти – тобто, вони мають активний центр, зв’язують субстрати і каталізують утворення продуктів. Рибозими знайдені в про- і еукаріотах, а також в органелах. Виявлено, що деякі дуже короткі РНК, які складаються з 19 основ, функціонують як рибозими. Більшість рибозимів є інтронами, що самостійно вирізаються і з’єднують кінці екзонів, що залишаються. В одному із найкраще вивчених випадків у найпростішого Tetrahymena інтрон, що складається з 413 основ, діє як рибозим і вирізається із довгого попередника РНК. В даному випадку інтрон-рибозим діє як специфічна до певної послідовності ендорибонуклеаза, яка самовирізається з попередника іРНК. При цьому до неї приєднується нуклеотид гуанідин. Після з’єднання екзонів від рибозиму-інтрону відщеплюється короткий олігонуклеотидний фрагмент, а довша частина утворює кругову замкнену структуру.
Рис.5.6. Принцип дії рибозимів.
Ні в одному із приведених щойно процесів не беруть участі складні білки. Такий тип самовирізання (self-splicing) названо I. У II типі самовирізання здійснюється сплайсмосомою, але задіяні білки не мають активності РНКази. У наведених прикладах, на відміну від відомих білків-каталізаторів, рибозими діють один раз. Відомі і інші класи рибозимів, які діють багато разів. Прикладом такого ензиму є РНКаза Р. Вона не руйнує сама себе. По суті, це – рибонуклопротеїд. Але тут саме мала РНК (377 нуклеотидів у E. coli) є каталітичним компонентом. Аналогічно з білковими каталізаторами, всі рибозими мають бути вірно складені в просторі, тобто мати вірну вторинну і третинну структури. Роль білка в такого роду комплексах зводиться, ймовірно, до створення і підтримання вірної просторової конформації. У зв’язку з переглядом ролі РНК і виявлення її каталітичних властивостей, переглядається і функція рРНК при синтезі білка.
Лекція 6 Регуляція експресії генів 1. Загальні положення 2. ДНК-зв’язуючі білки 3. Репресія 4. Індукція 5. Механізми індукції та репресії 6. Конститутивні білки та базальний рівень експресії 7. Оперони та регулони 8. Позитивний контроль 9. Альтернативні σ-фактори 10. Аттенуація 11. Глобальний контроль 12. Проведення сигналу і двохкомпонентні регуляторні системи 13. Особливості експресії генів у еу- і прокаріотів 14. Антисенсові нуклеїнові кислоти
1.Загальні положення Експресія генів – виявлення активності. У більшості випадків кодовані білки є ферментами. Тому нерідко про рівень експресії судять на основі активності відповідних ферментів. Проте це не зовсім вірно. Тому є кілька рівнів регуляції активності ферментів.
Рис. 6.1. Рівні регуляції активності ферментів.
Регуляція відбувається на рівні транскрипції, трансляції і посттрансляційному. Експериментально це можна встановити, використовуючи спеціальні інгібітори. Наприклад, циклогексемід інгібує синтез РНК у еукаріотів, антибіотик актиноміцин D блокує синтез білка у еукаріотів, левоміцетин (хлоромфенікол) у бактерій. Блокування реплікації і трансляції просто не дозволяє утворюватися відповідним поліпептидам. Посттрансляційна модифікація здійснюється багатьма шляхами. Їх поділяють на ковалентні і нековалентні. Перші зачіпають зміни у хімічному складі поліпептидів. До них належать:
|