Использование реагента в избытке (по отношению к теоретически необходимому количеству)
Для реакции типа: nаА + nвВ ® nрР. Относительный избыток одного из исходных веществ в потоке питания можно определить следующим образом:
еВ = [СВ0· (nа/nв) – СА0]/СА0, (1.2) где: еВ – относительный избыток исходного вещества В, СА0 и СВ0 – мольные концентрации исходных веществ А и В в потоке питания, nа, nв – стехиометрические коэффициенты реагентов А и В. Избыток реагента может привести к выгодному смещению положения равновесия в соответствии с законом действия масс. Пример, применение избытка О2 в реакции окисления SO2 до SO3:
2SO2 + O2 «2SO3 Константа равновесия этой реакции, отнесенная к парциальным давлениям, равна:
С повышением парциального давления кислорода в газах, поступающих на реакцию, возрастает значение знаменателя, а, следовательно, чтобы величина Кр осталась постоянной, необходимо одновременное увеличение числителя. Это означает, что состояние равновесия реакции смещается в направлении образования продукта.
|

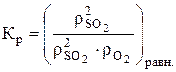 .
.


