Химическая концепция метода
Процесс производства разбавленной азотной кислоты складывается из трех стадий: конверсия аммиака с целью получения оксида азота 4NH3 + 5O2 = 4NO + 6H2O(4.1) окисление оксида азота до диоксида 2NO + O2 абсорбция оксидов азота водой 4NO2 + O2 + 2H2O = 4HNO3(4.3) Физико-химические основы процесса конверсии аммиака Окисление аммиака кислородом воздухом без катализатора возможно только до N2. На катализаторе между аммиаком и кислородом протекают следующие реакции: 4NH3 + 5O2 = 4NO + 6H2O; H = – 946кДж(4.1) 4NH3 + 3O2 = 2N2 + 6H2OH = – 1328кДж(4.4) Реакции окисления аммиака сопровождаются значительной убылью свободной энергии, протекают с большой скоростью, практически необратимо. Теплоты, выделяющейся во время реакции, вполне достаточно, чтобы процесс шел автотермично. Каталитическое окисление аммиака – многостадийный гетерогенно-каталитический процесс, протекающий во внешнедиффузионной области и лимитируемый диффузией аммиака к поверхности катализатора. Катализаторы, применяемые для окисления аммиака, должны обладать избирательными свойствами, т.е. ускорять только одну реакцию. Наиболее активным и селективным катализатором является платина. Она также имеет низкую температуру зажигания ~ 200 єС, хорошую пластичность, тягучесть. Но ее недостаток – это быстрое разрушение при высоких температурах при воздействии больших скоростных потоков реагентов и катализаторных ядов. Это приводит к потерям дорогостоящего катализатора и выхода оксида азота, что явилось причиной использования сплавов платины с другими металлами. Наибольшее распространение получили следующие катализаторы (ГОСТ 3193-59): Pt + 4% Pd + 3,5% Rh – для работы при атмосферном давлении и Pt + 7,5% Rh – при повышенном давлении. Катализаторы изготавливают в виде сеток. Такая форма удобна в эксплуатации и связана с минимальными затратами металла. Катализаторы весьма чувствительны к ряду примесей, содержащихся в аммиаке и воздухе, особенно к соединениям фтора и серы. Примеси заметно снижают селективность катализатора. Для поддержания стабильной степени конверсии необходима тщательная очистка АВС[1] и от механических примесей, особенно от оксидов железа и пыли железного катализатора синтеза аммиака. Срок службы до 14 месяцев при атмосферном давлении и до 9 при повышенном. Температура оказывает наибольшее влияние на выход оксида азота (II). При повышении температуры выход NO растет, причем существует оптимальная температура (для чистой платины 900 – 920 єС), при которой достигается максимальный выход. Большое значение имеет температура зажигания катализатора, которая зависит в основном от его состава. На платине реакция начинается при 195 єС. Выход достигает значения 96% на чистой платине и 99% на сплавах. Проведение процесса при высоких температурах помимо увеличения выхода монооксида азота имеет и другие преимущества: растет скорость реакции окисления аммиака и уменьшается время контактирования. Но при повышении температуры увеличиваются потери дорогостоящей платины, т.е. ухудшаются экономические показатели процесса. С ростом давления наблюдается снижение выхода оксида азота (II). Вместе с тем использование высокого давления позволяет повысить производительность агрегата, уменьшить размеры аппаратов. Процесс осуществляется под давлением 0,41 – 0,73 МПа. Основным условием получения высоких выходов NO под давлением являются повышение температуры и времени контактирования (увеличение числа сеток). При стехиометрическом соотношении кислорода и аммиака O2: NH3 = 1,25 даже при атмосферном давлении выход оксида азота не превышает 60 – 80%. Кроме того, пришлось бы работать в области взрывоопасных концентраций. При увеличении соотношения O2: N до 1,7 что соответствует содержанию аммиака в смеси 11,5%, выход NO возрастает.д.ля получения высокого выхода NO необходим 30% -ный избыток кислорода сверх стехиометрического. Это связано с тем, что поверхность платинового катализатора должна постоянно быть покрыта кислородом, иначе уже при 500 єС аммиак начинает разлагаться на азот и кислород.
Окисление оксида азота (II)
Реакция окисления 2NO + O2 обратима, протекает с уменьшением объема и сопровождается выделением тепла. Следовательно, снижение температуры и повышение давления способствует образованию NO2. При температурах до 100 єС равновесие реакции практически полностью сдвинуто в правую сторону. Окисление диоксида азота – самая медленная стадия получения азотной кислоты. Она сильно зависит от концентрации реагентов, давления температуры. Применение воздуха, обогащенного кислородом (или чистого кислорода) позволяет получать НГ[2] с повышенным содержанием оксида азота (II) и увеличить скорость окисления NO в NO2. Реакция окисления NO в NO2 ускоряется при понижении температуры, а с повышением замедляется почти до полного прекращения. Это объясняется тем, окисление NO в NO2 идет через образование промежуточного продукта – димера оксида азота (II): 2NO 2 + (NO) 2 Таким образом, уменьшение скорости окисления оксида азота в диоксид с повышением температуры можно объяснить сильным снижением концентрации димера. Обычно переработку нитрозных газов ведут при температурах 10 – 50 єС, при которых часть диоксида полимеризуются в N24. Итак, нитрозные газы, поступающие на абсорбцию, содержат NO2, N2O4, NO, N2O, N2, N2O3.
|

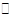 2NO(4.2)
2NO(4.2)


