Тиосерная кислота и тиосульфаты. Получение в лаборатории и свойства. Практическое применение тиосульфата натрия. Биологическая роль серы и ее круговорот в природе.
Тиосерная кислота — неорганическое соединение, двухосновная сильная кислота с формулой H2SO3S, бесцветная вязкая жидкость, реагирует с водой. Термически неустойчива.Быстро, но не мгновенно, разлагается в водных растворах. В присутствии серной кислоты разлагается мгновенно. Образует соли — тиосульфаты. Тиосульфа́ты — соли и сложные эфиры тиосерной кислоты, H2S2O3. Тиосульфаты неустойчивы, поэтому в природе не встречаются. Наиболее широкое применение имеют тиосульфат натрия(Na2S2O3) и тиосульфат аммония ((NH4)2SO3S). Получение тиосерной кислоты: 1) Реакция сероводорода и триоксида серы в этиловом эфире при низких температурах: Химические свойства тиосерной кислоты: 1)Термически очень неустойчива: 2)В присутствии серной кислоты разлагается: 3)Реагирует с щелочами: 4)Реагирует с галогенами: Тиосульфаты получаются: 1) при взаимодействии растворов сульфитов с сероводородом: 2)При кипячении растворов сульфитов с серой: 3)При окислении полисульфидов кислородом воздуха: Химические свойства тиосульфатов: 1)При нагревании до 220 °C распадается по схеме: 2)Тиосульфаты - сильные восстановители:С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты: 3)Более слабыми или медленно действующими окислителями, например, иодом, переводится в соли тетратионовой кислоты: 4)Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается: 5)Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению. Практическое применение тиосульфата натрия: в фотографии,аналитической и органической химии,горнорудной промышленности, текстильной и целлюлозно-бумажной промышленности, пищевой промышленности, медицине. Биологическая роль серы: Как и элементы органогены, сера в виде отдельного элемента не обладает биологическим значением. Ее биологическая роль состоит в том, что она входит в структуру таких аминокислот, как цистеин и метионин, которые и выполняют в животных организмах (в том числе у человека), ряд незаменимых функций. Круговорот серы в природе: Растения получают ее из почвы в виде серной кислоты; во всяком другом виде сера для зеленых растений недоступна. В теле растения серная кислота путем сложных, пока еще не разъясненных химических преобразований служит материалом для построения белковых веществ, в которых сера находится уже в совершенно иной форме, чем в серной кислоте. В то время, как сера в виде серной кислоты соединена с кислородом, газом, находящимся в воздухе и поддерживающим всякое горение и дыхание, в белках сера уже оторвана от кислорода и соединена с другим элементом с углеродом, который сам по себе представляет обыкновенный уголь. При разложении белков после смерти животного или растения, гнилостные бактерии отрывают серу из белков и выпускают ее в соединении с новым элементом водородом. В таком соединении сера представляет собой тот отвратительный вонючий газ, обладающий запахом тухлых яиц, который всегда образуется при гниении белков и о котором уже была речь раньше. В виде сероводорода сера и попадает в почву.
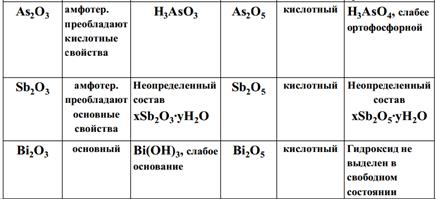
15. Химия элементов 5 А группы. Распространенность в природе, минералы. Водородные и кислородные соединения. Оксиды и гидроксиды различных степеней окисления. Изменение кислотно-основных и окислительно-восстановительных свойств соединений мышьяка, сурьмы и висмута в степенях окисления +3 и +5. Химия элементов 5 А группы: В группу входят азот N, фосфор P, мышьяк As, сурьма Sb и висмут Bi[3]. Элементы главной подгруппы V группы, имеют пять электронов на внешнем электронном уровне. В целом характеризуются как неметаллы. Способность к присоединению электронов выражена значительно слабее, по сравнению с халькогенами и галогенами. Все элементы подгруппы азота имеют электронную конфигурацию внешнего энергетического уровня атома ns²np³ и могут проявлять в соединениях степени окисления от −3 до +5[3]. Вследствие относительно меньшей электроотрицательности связь с водородом менее полярна,чем связь с водородом халькогенов и галогенов. Водородные соединения этих элементов не отщепляют в водном растворе ионы водорода, иными словами, не обладают кислотными свойствами. Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл. Таким образом, в данной группе резко изменяются свойства составляющих её элементов: от типичного неметалла до типичного металла. Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении её разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка. Распространенность в природе, минералы. Азот - важнейшая составная часть атмосферы (78% ее объема). В природе встречается в белках, в залежах нитрата натрия. Природный азот состоит из двух изотопов: 14N (99,635% массы) и 15N (0,365% массы). Фосфор входит в состав всех живых организмов. В природе встречается в виде минералов. Фосфор широко применяется в медицине, сельском хозяйстве, авиации, при добыче драгметаллов. Мышьяк, сурьма и висмут распространены достаточно широко, в основном в виде сульфидных руд. Мышьяк - один из элементов жизни, способствующий росту волос. Соединения мышьяка ядовиты, но в малых дозах могут оказывать лечебное свойства. Мышьяк применяется в медицине и ветеринарии. Водородные и кислородные соединения.1)Для азота известны оксиды, отвечающие всем его положительным степеням окисления (+1,+2,+3,+4,+5): N2O, NO, N2O3, NO2, N2O4, N2O5. При обычных условиях азот с кислородом не взаимодействует, только при пропускании через их смесь электрического разряда. Молекула азотной кислоты HNO3 состоит из трех элементов, соединенных между собой ковалентными связями. Это молекулярное вещество, содержащее предельно окисленный атом азота. Однако валентность азота в кислоте равна четырем вместо обычной степени окисления азота. Аммиак - одно из важнейших водородных соединений азота. Он имеет огромное практическое значение. Жизнь на Земле во многом обязана некоторым бактериям, которые могут перерабатывать азот воздуха в аммиак. 2)Соединения фосфора с водородом представляет собой газообразный фосфористый водород, или фосфин PH3 (бесцветный ядовитый газ с чесночным запахом, воспламеняется на воздухе). У фосфора несколько оксидов: оксид фосфора (III) P2O3 (белое кристаллическое вещество, образуется при медленном окислении фосфора в условиях недостатка кислорода, ядовит) и оксид фосфора (V) P2O5 (образуется из P2O3 при его нагревании, растворим в воде с образованием фосфористой кислоты средней силы) наиболее важные. Наиболее характерный свойством второго является гигроскопичность (поглощение паров воды из воздуха), при этом он расплывается аморфную массу HPO3. При кипячении P2O5образуется фосфорная кислота H3PO4 (белое кристаллическое вещество, расплывается на воздухе, tпл=42,35оС,не ядовита, растворима в воде, электролит, получают, окисляя 32%-ую азотную кислоту). Фосфаты почти всех металлов (кроме щелочных) нерастворимы в воде. Дигидрофосфаты хорошо растворимы в воде. Оксиды и гидроксиды различных степеней окисления. N2O, NO, N2O3, NO2, N2O4, N2O5,P2O3,P2O5,P2O3,As2O3, As2O5, Sb2O3, Sb2O5, Вi2О3, Вi2О5, Вi(ОН)3. Изменение кислотно-основных и окислительно-восстановительных свойств соединений мышьяка, сурьмы и висмута в степенях окисления +3 и +5.
Азот, нахождение в природе. Соединение с водородом,галогенами, кислородом. Аммиак, получение, свойства и его соли. Азотоводородная кислота, соли азиды. Амиды, имиды и нитриды металлов.Биологическая роль азота. Азо́т — 1s 22s 22p 3. Элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером7. Обозначается символом N. Простое вещество азот — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2), из которого на три четверти состоит земная атмосфера. Нахождение в природе: В большой части азот находится в природе в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78, 2 % (об.) азота. Над одним квадратным километром земной поверхности в воздухе находиться 8 млн. т азота. Общее содержание его в земной коре оценивается величиной порядка 0.03 мол. доли, %. Азот входит в состав сложных органических соединений- белков, которые входят в состав всех живых организмов. В результате отмирания последних и тления их останков образуются более простые азотные соединения, которые при благоприятных условиях, (главным образом - отсутствие влаги) могут накапливаться. Именно такого происхождения, по – видимому, залежи NaNO3в Чили, имеющие некоторое промышленное значение в производстве связанного азота, то есть в виде соединений. Также в природе встречается такой минерал, как индийская селитра K NO3. По словам известного советского микробиолога В. Л. Омелянского, «азот более драгоценен с общебиологической точки зрения, чем самые редкие из благородных металлов». Соединение с водородом,галогенами, кислородом:1) Аммиак — соединение азота с водородом. Имеет важное значение в химической промышленности. Формула аммиака — NH5. 2) Азотная кислота HNO3 — сильная одноосновная кислота. В разбавленных растворах она полностью распадается на ионы Н* и NO. 3) С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3).Галогениды азота неустойчивы и легко разлагаются при нагревании (некоторые — при хранении) на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается:2NI3 = N2 + 3I2. 4) Для азота известны окислы, по составу формально отвечающие всем валентностям от. единицы до пяти: N2 O – закись азота, NO – окись азота, N2 O3 – азотистый ангидрид, NO2 – двуокись азота, N2 O5 – азотный ангидрид. Аммиак, получение, свойства и его соли.Аммиак — соединение азота с водородом. Имеет важное значение в химической промышленности. Формула аммиака — NH5. Получение аммиака 1) В промышленности получение аммиака связано с прямым его синтезом из простых веществ. Как уже отмечалось, источником азота служит воздух, а водород получают из воды.3H2 + N2 -> 2NH3 + Q. 2) Получение аммиака в лабораторных условиях производят из смеси твёрдого хлорида аммония (NH4Cl) и гашенной извести. При нагревании интенсивно выделяется аммиак.2NH4Cl + Ca(OH)2 -> CaCl2 + 2NH3 + 2H2O. Свойства аммиака: 1)присоединяет протон, образуя ион аммония: 2) Взаимодействуя с кислотами даёт соответствующие соли аммония: 3) Амиды щелочных металлов получают, действуя на них аммиаком: 4) Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу: 5) При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
6) Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин: 7) С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов): 8) Соли аммиака: Соли аммония - твёрдые кристаллические вещества, не имеющие окраски. Почти все они растворяются в воде, и им характерны все те же свойства, которые имеют известные нам соли металлов. Они взаимодействуют со щелочами, при этом выделяется аммиак. Азотоводородная кислота, соли азиды. Азо́тистоводоро́дная кислота́, азоими́д, HN3 — кислота, соединение азота с водородом. Бесцветная, летучая, чрезвычайно взрывоопасная (взрывается при нагреве, ударе или трении) жидкость с резким запахом. Очень токсична. Её хорошо растворимые соли тоже очень ядовиты. Механизм токсичности аналогичен цианидам (блокирование цитохромов). Азиды- химические соединения, содержащие одну или несколько групп — N3, производные азотистоводородной кислоты (См.Азотистоводородная кислота) HN3. К неорганическим А. относятся соли HN3 [например, А. натрия NaN3, А. свинца Pb(N3)2], галогеназиды (например, хлоразид CIN3) и др. Большинство неорганических А. взрывается при лёгком ударе или трении даже во влажном состоянии; таков, например, Азид свинца, применяющийся как инициирующее взрывчатое вещество. Исключение составляют NaN3 и др. соли щелочных и щёлочноземельных металлов. Исходным материалом для получения др. солей HN3, а также самой кислоты обычно служит А. натрия, получаемый пропусканием закиси азота через расплавленный амид натрия: NaNH2 + ON2 = NaN3+H2O. Все органические А., алкильные и арильные (общей формулы RN3) или ацильные ( Амиды, имиды и нитриды металлов. Амиды металлов MeNH2 — соединения, содержащие ионы NH2−. Амиды являются аналогами гидроксидов, но являются более сильными основаниями. Некоторые амиды растворяются в аммиаке, причем амид растворим в аммиаке так же, как и гидроксид этого металла в воде. Аммиачные растворы амидов проводят электрический ток.В амиде один или два атома водорода могут быть замещены на органические радикалы, как, например, в диизопропиламиде лития LiN(C3H7)2 ИМИДЫ МЕТАЛЛОВ -соед. общей ф-лы М2/nNН, где п - степень окисления металла М. Легко гидролизуются водой, образуя гидроксид металла и NH3. При нагр. переходят в нитриды металлов или разлагаются на своб. металл, N2 и Н2. Получают имиды металлов нагреванием амидов металлов в вакууме при 400-600 °С. Известно небольшое число имидов металлов. Наиб. изучен имид лития Li2NH, к-рый существует в двух кристаллич. модификациях; до 83 °С устойчива форма с тетрагон. решеткой (а = 0,987 нм, b = 0,970 нм, с = 0,983 нм, z = 16; плотн. 1,20 г/см3), выше 83°С - с кристаллич. решеткой типа антифлюорита (плотн. 1,48 г/см3). Получено множество орг. производных имидов металлов, в к-рых атом водорода замещен на орг. pадикал. П. И.Чукуров. Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
|

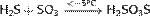 ; 2) Действие газообразного хлористого водорода на тиосульфат натрия:
; 2) Действие газообразного хлористого водорода на тиосульфат натрия: 

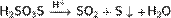

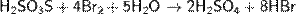


 ,
, 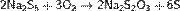
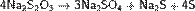
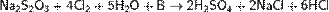
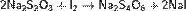

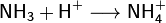
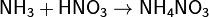

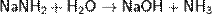
 ;
; 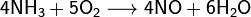
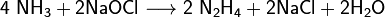
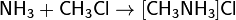
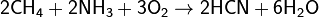
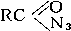 2)N3.
2)N3.


