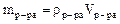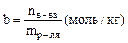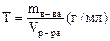ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ. 1. Способы количественного выражения состава растворов
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ПЛАН ЗАНЯТИЯ 1. Способы количественного выражения состава растворов. Массовая доля растворенного вещества, ее связь с плотностью раствора. 2. Определение плотности растворов в лаборатории. Устройство ареометра. 3. Приготовление растворов с заданной массовой долей, молярной или нормальной концентрацией растворенного вещества: а) из безводного твердого вещества и воды; б) из кристаллогидрата и воды; в) из концентрированного раствора и воды; г) смешением растворов; д) из стандарт-титров (фиксаналов). ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ Для количественного выражения состава растворов используют разные физические величины. Рассмотрим некоторые из них. Массовая доля растворенного вещества (ω) – отношение массы вещества к массе всего раствора. Эта величина выражается в долях единицы или в процентах и показывает, какую часть массы раствора составляет растворенное вещество:
Например, запись «20%-ный водный раствор» означает, что ω = 0,2 или 20%, т. е. в каждых 100 г раствора содержится 20 г вещества и 80 г воды.
Плотность раствора (ρ, г/см3 или г/мл), соответствующую определенной массовой доле растворенного вещества, находят в справочных таблицах. Плотность раствора можно измерить в лаборатории с помощью ареометра. Он представляет собой запаянную стеклянную ампулу, в расширенную часть которой помещена металлическая дробь, залитая эпоксидной смолой, а внутри узкой верхней части находится шкала с делениями. Ареометр, опущенный как поплавок в цилиндр с раствором, погружается в него до определенного деления, которое и указывает на плотность раствора. Обычно в лабораториях имеются наборы ареометров, шкала которых рассчитана на измерение плотности в небольшом интервале. Зная плотность, находят массовую долю растворенного вещества. Рис. Определение плотности жидкости ареометром. Раствор наливают в высокий цилиндр и опускают ареометр так, чтобы он не касался стенок и дна сосуда. Отмечают то деление шкалы, которое совпадает с уровнем жидкости в цилиндре, производя отсчет по шкале сверху вниз Объемная доля растворенного вещества (j) — отношение объема вещества к общему объему раствора:
Этот способ используется для выражения состава растворов жидких веществ в жидкостях и газовых растворов. Например, j азота в воздухе составляет 78%. Это означает, что в 1 л воздуха содержится 0,78 л азота и 0,22 л других газов. Молярная, или мольная, доля (χi) — отношение количества вещества (ni моль) одного из компонентов раствора (i) к общему количеству вещества всех компонентов. Так, если раствор состоит из компонентов А, Б, В, включая растворитель, то молярная доля вещества А составит
Молялъность (b) выражается содержанием количества растворенного вещества (n) в 1 кг растворителя:
Так, для приготовления одномоляльного водного раствора необходимо смешать 1 моль растворяемого вещества с 1 кг (1000 мл) воды. Если в приведенной выше формуле nв-ва заменить на то выражение принимает вид
Титр (Т) выражается массой растворенного вещества (в граммах), содержащейся в 1мл раствора:
так, если Т = 0,05 г/мл, это означает, что в 1 мл раствора содержится 0,05 г растворенного вещества. Растворы с известным титром называют титрованными, они используются при количественном анализе в аналитической химии. Молярная концентрация (С) выражается содержанием количества растворенного вещества (n) в единице объема раствора (V) и рассчитывается как отношение этих величин: Cв-ва = nв-ва/Vр-ра (моль/л) В лабораторной практике и при расчетах чаще используют последнюю единицу измерения см —моль/л. Выражение «одномолярный раствор» означает, что в 1 л его содержится 1 моль растворенного вещества. Растворы, в 1 л которых содержится 0,1 моль, 0,01 моль или 0,001 моль вещества, называют соответственно деци-, санти- или миллимолярными, их обозначают также 0,1М, 0,01М. Для приготовления раствора с заданной молярной концентрацией обычно необходимо вычислить не количество, а массу растворенного вещества. Так как n=m/M, то формула принимает вид Cв-ва = mв-ва/MVр-ра, откуда mв-ва = CMVр-ра Молярная концентрация эквивалентов, или нормальная концентрация (С), выражается содержанием количества эквивалентов растворенного вещества (nэкв) в единице объема раствора (V) и рассчитывается как отношение этих величин: Cв-ва = nэкв/Vр-ра (моль/л)
|

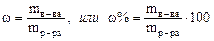
 В лаборатории обычно растворы не взвешивают, а определяют их объем с помощью мерной химической посуды. Зная объем, можно рассчитать массу раствора, используя соотношение
В лаборатории обычно растворы не взвешивают, а определяют их объем с помощью мерной химической посуды. Зная объем, можно рассчитать массу раствора, используя соотношение