Процентная концентрация С% – это
1.отношение массы растворенного вещества к общей массе раствора, выраженное в процентах; 2. количество молей растворенного вещества в 1 литре раствора; 3. количество молей растворенного вещества в 1 кг растворителя 4. количество эквивалентных масс растворенного вещества в 1 л раствора 2. Молярную концентрацию См можно определить по формуле: 1. 4. Какой объём 20,01 %-ного раствора НСI ( 10,17%-ного раствора (
5. Для осаждения всего серебра, содержащегося в 100 мл раствора AgN03, потребовалась 50 мл 0,2 Н раствора HCI. Чему равна нормальная концентрация раствора AgN03?
6. Определите осмотическое давление водно-спиртового раствора, содержащего 15% спирта (р = 0,97 г/мл) при 2930 К.
7.Раствор, содержащий в метаноле СН3ОН объемом 100 мл (р = 0,792 г/мл) иод массой 7,4 г, кипит при 65,00С.Температура кипения метанола 64,70С, эбулиоскопическая константа метанола 0,840. Сколько атомов иода содержится в молекуле иода в растворе.
Билет № 2 1.Массовая доля w 1. отношение массы растворенного вещества к общей массе раствора, выраженное в процентах; 2. количество молей растворенного вещества в 1 литре раствора; 3. количество молей растворенного вещества в 1 кг растворителя; 4. количество эквивалентных масс растворенного вещества в 1 л раствора
2.Процентную концентрацию можно определить по формуле: 1.
3. Определите нормальную и молярную концентрации 20%-ого раствора СаСI2 (
4. Какой объем 50%-ного раствора КОН ( 6%-ного раствора (
5. Для нейтрализации раствора NaOH потребовалось 24,85 мл кислоты HCl с нормальной концентрацией 0,1015 моль/л. Определите количество щелочи и ее массу.
6.В водном растворе объемом 750 мл содержится неэлектролит массой 3,0г. Осмотическое давление этого раствора при 00С равно 0,504
7.Раствор, содержащий фенол С6Н5ОН массой 3,6 г в бензоле С6Н6 массой 100г, замерзает при при 3,50С. Чистый бензол замерзает при температуре 5,50С. Определите криоскопическую константу бензола.
Билет № 3 1. Молярная концентрация См - это 1. отношение массы растворенного вещества к общей массе раствора, выраженное в процентах; 2. количество молей растворенного вещества в 1 литре раствора; 3. количество молей растворенного вещества в 1 кг растворителя; 4. количество эквивалентных масс растворенного вещества в 1 л раствора
2.Моляльную концентрацию моно определить по формуле: 1. 3.Определите молярную и нормальную концентрации 25%-ого раствора NH4CI (
4.Какой объем 50%-ного раствора КОН (
5.Для полного осаждения BaS04 из 100 г 15%-ного (по массе) раствора ВаС12 потребовалось 14,4 мл H2S04. Найти нормальность раствора H2S04.
6. Сколько молей неэлектролита должен содержать 1 л раствора, чтобы его осмотическое давление при 25°С было равно 2,47 кПа?
7.Определите температуру кипения и замерзания 9,5 % водного раствора глюкозы С2Н12О6. Крископическая константа воды равна 1,860, эбулиоскопическая константа воды равна 0,5160.
Билет № 4 1.Моляльная концентрация Сm 1. отношение массы растворенного вещества к общей массе раствора, выраженное в процентах; 2. количество молей растворенного вещества в 1 литре раствора; 3. количество молей растворенного вещества в 1 кг растворителя; 4. количество эквивалентных масс растворенного вещества в 1 л раствора.
2. Массовую долю можно определить по формуле: 1. 3.Плотность 15%-ного (по массе) раствора H2S04 равна 1,105 г/мл. Определите: нормальную, молярную и моляльную концентрации раствора.
5.Какойобъем 0,2 н. раствора щелочи потребуете дл я осаждения в виде Fe(OH)3 всего железа, содержащегося в 100 мл 0,5 н. раствора FeCl3?
6.При 20°С смешивают 1 л раствора неэлектролита, осмотическое давление которого 243,4 кПа, с 3 л раствора неэлектролита, осмотическое давление которого 486,8 кПа. Найти осмотическое давление смешанного раствора.
7. При какой приблизительно температуре будет кристаллизоваться 40%-ный (по массе) раствор этилового спирта С2Н5О Н? Крископическая константа воды равна 1,860
|

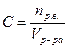 ; 2.
; 2.  ; 3.
; 3. 
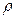 = 1,100 г/мл) требуется для приготовления 1 л
= 1,100 г/мл) требуется для приготовления 1 л – это
– это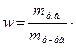 , 2.
, 2. 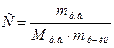 3.
3. 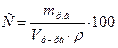
 105Па. Какова молярная масса неэлектролита.
105Па. Какова молярная масса неэлектролита.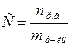 2., 2.
2., 2.  4.Какой объем 10%-ного раствора карбоната натрия (
4.Какой объем 10%-ного раствора карбоната натрия (


