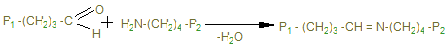Проколлаген
N-концевой Пептид С-концевой Пептид Проколлагенпептидаза
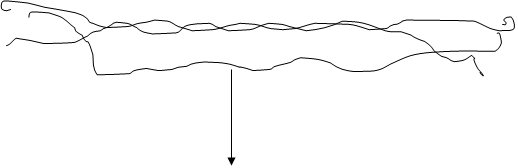
Тропоколлаген Рис. Превращение проколлагена в тропоколлаген. Перекрывание 64-67 нм
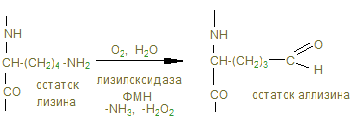
Нм 400 нм Рис. Расположение молекулы тропоколлагена в четыре ряда. Коллагеновым волокнам свойственно два типа поперечных связей: внутримолекулярные – в пределах одной тропоколлагеновой единицы между NН и СО и межмолекулярные – между отдельными тропоколлагеновыми единицами. В образовании внутримолекулярных поперечных связей в коллагене участвуют боковые цепи лизина. Внеклеточный медь-содержащий фермент, лизилоксидаза, осуществляет окислительное дезаминирование ε-аминогрупп некоторых лизиловых и гидроксилизиловых радикалов.
Именно они могут образовывать поперечные связи, реагируя с остатками лизина и оксилизина, а также друг с другом, с образованием шиффовых оснований и альдолей - между полипептидами Р1 и Р2.
Эти шиффовы основания подвергаются химической перегруппировке, обеспечивая стабильные ковалентные сшивки. При дефиците лизилоксидазы или нарушении метаболизма меди нарушается образование поперечных связей, что ведет к аномалиям коллагена - причиной наследственных болезней. Наиболее известные среди них: синдром Марфана, синдром Элерса-Данлоса и синдром Менке (синдром курчавых волос). При этом наблюдается дефекты в развитии скелета повышенная растворимость коллагенов, поражения кожи, сосудов.
|