Необратимые и обратимые реакции. Химическое равновесие.
Равновесным состоянием называют такое термодинамическое состояние системы, которое не изменяется во времени. Устойчивое равновесное состояние характеризуется: - неизменностью состояния системы при сохранении внешних условий; - подвижностью равновесия: самопроизвольным восстановлением равновесия после прекращения воздействия, вызывающего отклонение системы от положения равновесия; - динамическим характером равновесия: сохранением его вследствие равенства скоростей прямого и обратного процессов; - различием в достижении равновесного состояния для самопроизвольных и несамопроизвольных процессов; - минимальным значением энергии Гиббса (или энергии Гельмгольца).
В основе учения о химическом равновесии реакций лежит закон действующих масс. Запишем в общем виде уравнение обратимого химического процесса: аА + вВ ↔ сС + dD Химическое равновесие численно выражается константами равновесия - постоянными величинами для данной температуры. Если количества реагирующих веществ выразить через равновесные концентрации, то константа равновесия будет выглядеть следующим образом:
Уравнение (3.1.) – уравнение химического равновесия или математическое выражение закона действующих масс применительно к обратимым реакциям. Если в реакции участвуют газообразные вещества, то действующие массы выражают через их парциальные давления:
В условиях равновесия при данной температуре отношение произведения равновесных концентраций (или парциальных давлений для газообразных веществ) продуктов реакции к произведению концентраций (или парциальных давлений) исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам, постоянно. Между константами Кс и Кр существует связь: Кр= Кс(RT)∆n, (3.2) где ∆n= (c+d) – (a+b) – разность стехиометрических коэффициентов или изменение числа молей в результате реакции. Если же реакция идет без изменения числа молекул (∆n=0), то Кр= Кс На химическое равновесие можно воздействовать и смещать его в нужном направлении, т.е. изменять выход продуктов реакции. Изучение явлений химического равновесия в гомогенных системах позволило Ле-Шателье сформулировать принцип смещения химического равновесия: Если изменить одно из условий, при которых система находится в состоянии химического равновесия, то равновесие смещается в направлении той реакции, которая противодействует произведенному изменению. Смещение химического равновесия в основном определяется: - концентрацией реагирующих веществ; - давлением, если реагирующие вещества находятся в газообразном или парообразном состоянии; - температурой, при которой происходит химический процесс. Причиной смещения химического равновесия при изменении концентрации, давления реагирующих веществ или температуры процесса является нарушение равенства скоростей прямой и обратной реакций. Это смещение будет продолжаться до тех пор, пока скорости этих реакций снова не сравняются. Влияние концентрации: увеличение концентрации веществ приводит к смещению равновесия в сторону увеличения расхода тех компонентов (или компонента), концентрация которых увеличивается. Влияние давления (для газообразных веществ): смещение равновесия при изменении давления зависит от изменения числа молей (∆n) в процессе реакции. При ∆n= 0 смещение равновесия при увеличении или уменьшении давления не произойдет. При ∆n≠ 0, равновесие смещается следующим образом: а) если процесс идет с увеличением числа молей продуктов реакции - ∆n> 0, то увеличение давления приведет к смещению равновесия в сторону образования исходных веществ, а уменьшение давления – в сторону продуктов реакции; б) если процесс идет с уменьшением числа молей продуктов реакции - ∆n< 0, то увеличение давления приведет к смещению равновесия в сторону образования продуктов реакции, а уменьшение давления – в сторону исходных веществ. Так для реакции образования аммиака: 3Н2 + N2↔ 2NH3 (∆n= 2 - 4 = -2) увеличение давления в системе приведет к смещению равновесия в сторону продукта реакции – аммиака - и, соответственно, к большему его выходу. Влияние температуры: увеличение температуры системы приведет к смещению равновесия в сторону эндотермической реакции: а) если реакция экзотермическая (идет с выделением тепла), увеличение температуры системы приведет к смещению равновесия в сторону исходных веществ; уменьшение температуры (например, отвод тепла от системы) – смещение равновесия в сторону продуктов реакции. б) если реакция эндотермическая (идет с поглощением тепла), увеличение температуры системы приведет к смещению равновесия в сторону продуктов реакции; уменьшение температуры – в сторону образования исходных веществ. Рассмотрим состояние химического равновесия с точки зрения термодинамических функций состояния. Пусть реакция аА + bВ ↔ сС + dD протекает при постоянной температуре. Начальное 1 и конечное состояние 2 этой системы определяется следующим образом. Состояние 1 соответствует а моль Aи bмоль В; их парциальные давления будут РА и РВ при температуре Т. Состоянию 2 соответствует с моль С и dмоль D; их парциальные давления – РС и РDпри той же температуре Т. Изменение свободной энергии (Гиббса или Гельмгольца) этой реакции равно: ∆GT= GT(состояние 2) - GT(состояние 1) Поскольку газы предполагаются идеальными, для каждого состояния свободная энергия равна сумме свободных энергий различных компонентов: GT(состояние 1) = аGT(РА) + bGT(РB); GT(состояние 2) = сGT(РС) + dGT(РD); Значения свободных энергий начального и конечного состояний определяют согласно соотношению: GTP= GT0+ RTlnP Опуская математические преобразования, покажем, что зная температуру процесса и значения парциальных давлений реагентов и продуктов реакции, при использовании таблиц термодинамических данных можно определить изменение свободной энергии ∆GTданного химического процесса:
Таким образом, мы получаем связь между изменением свободной энергии системы и константой равновесия процесса:
Т.к. ∆G0T - изменение свободной энергии в стандартных условиях постоянно, то при равновесии получим: ∆G0T= - RTlnKP (3.5) или
|

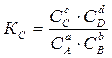 (3.1.)
(3.1.)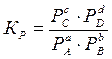 (3.1а)
(3.1а)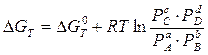 (3.3)
(3.3)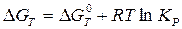 (3.4)
(3.4)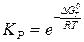 . (3.6)
. (3.6)


